さて、考察である。
取り敢えず、Ts.Marker 氏は自分の発見事実をブログで公開した。和モガ氏やアルイミオウジ氏とも連絡を取られている様子なので、裏ではある程度の意見交換があるのかもしれないが、一般の読者としては分からないから、ただ、事実報告しかない状態である。
それに対して、和モガ氏はこの事実に関する自分の解釈を書かれている。事件なのであるから、事件視点で何が行われたから、こういう科学的事実が出ているのかと問うことになる。
最初の推測はどこかの時点でクローンが作られているという推測から、ドナー核の周りにわずかに付着している細胞質からリシピエントの細胞質にミトコンドリアが混入するという推定をした。
ただし、和モガ氏のクローン説は日程検討に誤りが入っていて、私は既にそれを批判しているが修正はいまでにされていない。だからクローンがなぜ使われるのかの説明は疑義の入ったままに、その可能性を論じている事になるので、事件との絡みを離れている。
それを前提にして、それぞれの幹細胞はntESであり、インジェクション時にドナーの細胞質からわずかに入ったミトコンドリアがAの原因だとした。
>>
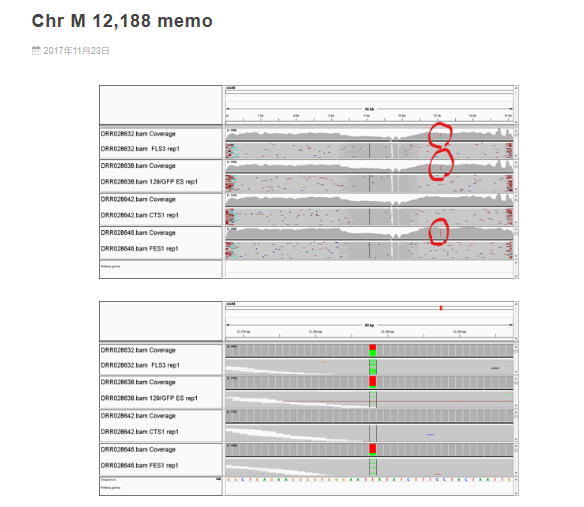
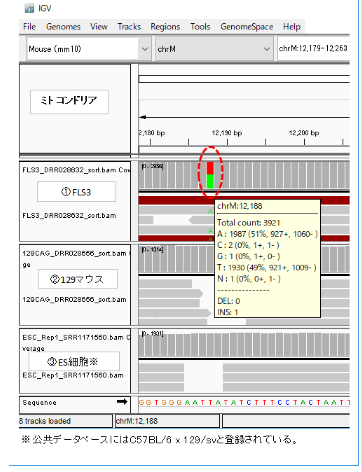
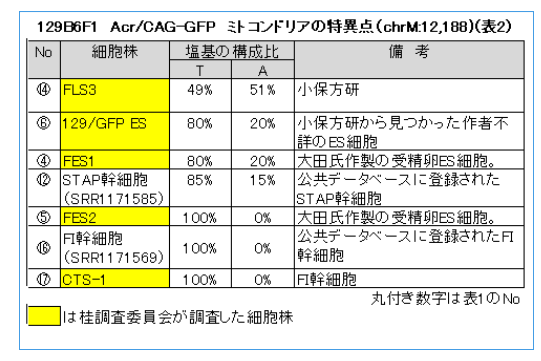
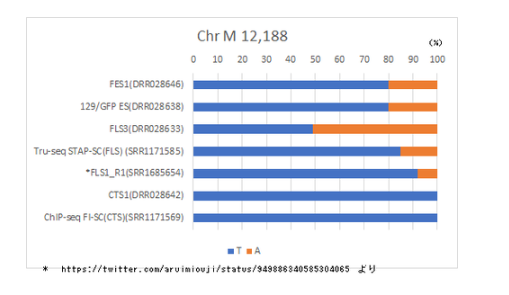
調査委員会はFLS3はFES1由来で、FES1は129×B6の受精卵ES細胞ということであった。それなら、mtDNAの12,188は②のように塩基Tで灰色表示されるはずである。作製者の太田氏は作成後、研究には使わなかったというので、突然変異が半分まで蓄積するはずもない。FLS3が受精卵ES細胞でないのは明らかだ。ここで、太田ESの嘘が暴かれた。太田ESは他にも嘘が多くて、証言に矛盾がある。
しかし、太田氏が使った129/Sv X1が市販のものであったのなら、調査現在のFES1の中身はその時の太田ESではないということになる。
ただ自家飼育の129/Sv X1のコロニーが維持されていたのなら、クローンであるとは言い切れない。言うまでもないが、小保方さんがFES1を渡したからFLSができたなんて話はもっと言いきれないことになる。要するに何にも調べられないまま、決めつけの結論を書いただけなのが桂報告書なのである。
そのことはさておいて、ここで和モガ氏は勘違いしている。リシピエントはICRである蓋然性が高い。今までの実験やその申請書でICRが書かれている。従って、市販のきれいなマウスだとTベースである。ここにAとして何が入ったのかという問題になる。和モガさんは逆を書いている。
>>
AとTが両方でるのは、FLS3が体細胞クローンで12,188番のTの塩基はドナーの129B6F1の129系塩基T(②)に、レシピエントのmtDNA(おそらくICRマウスで塩基はA)が混在しているからだと思われる。
しかも、加えてTs.Marker さんの調査ではICRはデータベースではTであった。
事実はTの中にAが入ったというだけのことである。まずは原因をクローン胚インジェクション操作だということに限定しないで考えた方が一般的考察になる。
和モガさんはSNPsを持ち出してきているが、核DNAでしかも近交系マウスに関して特に99%ホモになっているローカスのその近交系マウスに特異的SNPsが登録されている。そしてミトコンドリアDNAは母系一本しかないので、その意味のヘテロは無いので紛らわしい。ただし、そのマウスのDNA配列は全部読まれていて、あの場所がAであるマウスはTs.Markerさんが調べた限りではNOD / ShiLtJだけだということである。
ここが一番ややこしてところであるが、ミトコンドリアDNAと言うのは呼吸に関係しているから酸素といつも接触していて活性酸素の影響で突然変異が核DNAより頻繁に起きる。5倍から10倍の速度で変異が入る。
ところが、核DNAは細胞の中に1セットしかないが、ミトコンドリアは細胞の中に平均数千個ある。組織細胞の違いによって数も違う。卵の中だと24万個あると言われている。mtDNAは一個のミトコンドリアの中に十数個ある。人間の細胞は数十兆個あるとされているが、その数千倍のmtDNAの数の中で、一つ変異するのである。違う細胞内のどこかでは違う場所に一個の変異がはいる。或いは同じ細胞内の別のミトコンドリアには違う変異が入る。同じmtDNAの違う箇所に又別の変異が入る。
少々変異が入っても生きている限り何も問題ない。特にミトコンドリア病とされるまで特殊なケースだけが医学で問題とされる。普通の大多数の人の大部分の人生でミトコンドリアの突然変異は無関係である。寿命には何か関係があるとはされているが、寿命は何時かは誰にでも来る。
Ts.Markerさんの報告している現象はそういう普通の変異ではないということに気づかないといけない。変異は1つしかない。1つの変異だけが培養細胞の中で何割という増え方をしているのである。
体細胞に系譜決定されてしまった細胞内では変異は拡大しない。10個の細胞中に一つだけ変異が入っている細胞があるとすると確率的には倍に増えると2個/20個になるだけです。死滅細胞が補充されるときそういう確率で補充される。
一個でも変異ntDNAの入っている細胞の状態をヘテロプラスミーと呼んでいる。変異の入り方はどういう入り方でもいい。細胞内の全てのntDNAに他と違う異質の変異DNAがある状態をヘテロプラスミーと呼ぶ。何か所も変異していていいし、何個も変異ミトコンドリアがあっていい。そして年を取るほどそういう細胞は多くなる。そして全然問題ない。
問題は卵細胞です。卵は1個で独立している細胞なんですね。この1個から数十兆個の細胞に分裂分化増殖していく。従って、この卵の中のミトコンドリアは正常なmtDNAだけを持っているのが理想です。このすべてが同じntDNAで揃っている細胞の状態をホモプラスミーと呼んでいる。
この卵細胞は卵割のかなり初期に将来の卵細胞になる場所が決まっている。そして卵原細胞から卵になるときにそれがヘテロだったら一度ボトルネック効果を使ってホモに戻され、排卵までの待機中に維持されていて、ここで変異が入るとどうなるのかもよくわかって無くて、受精後胚盤胞になる間にもまだボトルネック効果が使われているらしい。
(
どうなってんの?)分からんもの同士で何とか検討しようということです。
まずボトルネック効果の仕組みが分かってない。昔はいくつか変異の入っているミトコンドリアがあるとまず総数を極度に減らして変異ミトコンドリアを消してしまう。そして残った正常ミトコンドリアを増殖させるという仮説だったが、調べてみると数は数百程度にまでしか減っていないと分かった。それだけでは十分に排除できないので、核の側から何らかの指示が出ていて、ヘテロプラスミーミトコンドリアを排除するようになっているのではとも言われている。
逆にボトルネック効果で変異が増えてしまった卵はそれが致命的な変異である場合は卵細胞ごとアポトーシスするということである。
今回Ts.Marker氏が紹介してくれている論文は、受精後の段階でもまだボトルネック効果で、変異ミトコンドリアを含んでいる細胞を隔離しようとする働きがあるという証明になっている。これは生まれて後に死に至ることによって次世代への影響を排除していることになる。また、その効果はES細胞、つまりインナーセルマス段階でも残っているようである。ES細胞化した時にまだボトルネック効果が働いていて培養中の継代で更に隔離されていくのかどうかまでは分かってない。
和モガ氏はES段階になってもまだ培養中のボルネックがあるという説になっているが、そもそもその仕組みは分かってない。
>>
しかし、いったん出来たSTAP幹細胞を培養するとSTAP幹細胞は増殖するので、ミトコンドリアがホモプラスミー化することになる。専門家ですら確かには分かっていないことをど素人がどれだけ検討できるかということである。
しかし、我々の目的はなぜそうなっているのかを事件の視点から解明するだけであるから、専門家のようにとことん分からなければ、分かったことにならないということではない。どこまでそれが可能か、考えてみるより仕様がない。なぜ、一塩基だけ違うヘテロプラスミーが全体の何割というオーダーで存在し得るのか。
(細胞株の混合)一番考えやすいのは二種類の幹細胞が混ぜられているケースである。この特殊な変異は一か所だけでしか起きていない。裏返すとTのホモプラスミーの細胞とAのホモプラスミーの細胞を混合して、それをPCRに掛けると混合割合が分かるというケースである。
この場合、ボトルネック効果などは何の関係もない。
問題はTであるマウス種が大半で、この場所がAであることが当たり前のマウスは今のところTs.Marker さんによってはNOD / ShiLtJしか見つけられていない。
他のマウスでたまたまこの場所がAに突然変異したmtDNAができたのだとしたら、今度はこの突然変異が卵細胞の全体を占めた原因に遡らなければならなくなる。この時は二つの幹細胞が混ぜられたという話では収まらなくなる。
まず最初に混ぜ合わせただけだという説から検討しよう。
この場合は割合は作成の時系列は無関係で、混ぜられた時の割合がたまたまそうなっていたというだけのことで単純である。単純でないのは細胞質の違う幹細胞が混ぜられたのはいいが、その両者の核DNAの変異特徴が一致しているということである。これを同時に説明できないといけない。
(FES1)
WGS DRR028646 FES1 T:3625(80%) A
:921(20%)(FES2)
WGS DRR028652 FES2 T:5307(100%) A:4
(ntESG1)-mtDNA=ICR
WGS DRR028644 ntESG1 T:4990(100%) A:4
(ntESG2)-mtDNA=ICR
WGS DRR028650 ntESG2 T:4291(100%) A:1
(CD45+)-mtDNA=129X1/Sv
Tru-seq SRR1171556 CD45+ T:2000(100%) A:1
(STAP)-mtDNA=129X1/Sv
Tru-seq SRR1171580 STAP T:2396(100%) A:1
ChIP-seq input SRR1171584 STAP T: 178(100%) A:0
SMARTer-seq SRR1171578 STAP T: 970(100%) A:1
(STAP-SC)-mtDNA=129X1/Sv
Tru-seq SRR1171585 STAP-SC(FLS?Acr)
T:1245(85%) A:217(15%) ??ChIP-seq input SRR1171589 STAP-SC T: 171(100%) A:0
WGS DRR028632 FLS3
T:1949(49%) A:1992(50%)WGS DRR028633 FLS3
T:1912(49%) A:2015(51%)(FI-SC)
Tru-seq SRR1171565 FI-SC(B6+α?) T:2212(100%) A:2
ChIP-seq input SRR1171569 FI-SC(CTS?Acr) T: 144(100%) A:0
WGS DRR028642 CTS1 T:3718(100%) A:4
WGS DRR028643 CTS1 T:3667(100%) A:5
(ESC)
Tru-seq SRR1171560 ESC T:1572(100%) A:0
ChIP-seq input SRR1171564 ESC T: 191(100%) A:0
SMARTer-seq SRR1171574 ESC T:1396(100%) A:0
(TSC)-mtDNA=ICR
Tru-seq SRR1171590 TSC T:2359(100%) A:0
ChIP-seq input SRR1171594 TSC T: 229(100%) A:0
(Epi-SC)-mtDNA=129X1/Sv
Tru-seq SRR1171558 Epi-SC T:1103(100%) A:0
(129/GFP ES)
WGS DRR028638 129/GFP ES
T:2963(80%) A:733(20%)(129CAGマウス)
WGS DRR028656 129CAG T:1219(100%) A:0
(129X1/SvJ マウス)
WGS Illumina HiSeq 2000 SRR1614029 129X1/SvJ T:3(100%) A:0 G:0 C:0
(ICR ?マウス )
SRR2917581 ICR ? T:219(100%) A:0
(DBA/2Jマウス)
Mouse strain assembly hub DBA/2J T
(129S1/SvImJマウス)
Mouse strain assembly hub 129S1/SvImJ T
(BALB/cJマウス)
Mouse strain assembly hub BALB/cJ T
(C57BL/6NJマウス)
Mouse strain assembly hub C57BL/6NJ T
(NOD/ShiLtJマウス)
Mouse strain assembly hub NOD/ShiLtJ
AこうやってみるとFES1、FLS3、129/GFP ESの三つが混ぜ物だということだね。
和モガさんの最初の直感が正しそうだ。でも、129X1/SvはTだから、ホモでAがあり得る集団としてはICRとNOD/ShiLtJしかない。従って、混ぜられた細胞が受精卵ESだということはあり得なくて、ntESだということになる。リシピエントマウスとしてAであるICRマウスか、NOD/ShiLtJが使われたとするよりないが、NOD/ShiLtJは免疫不全マウスなので通常はクローン胚のリシピエントとしては使われない。ICRマウスは近交系マウスではない。従ってAのICRマウスがあるのならば解決する。
もう一つの問題は何のために混ぜ合わせたのか、どうやって混ぜ合わせたのかということである。今まではすべてFLS3だと見ていた。これがntESだっただけで、若山さんが太田ESを取り寄せてFES1にFLSを混ぜたとした。129/GFP ESも同様にFES1にFLS3を入れたものだとしていた。ところが、このミトコンドリアDNAの変異分布がその可能性を許さなくなった。
我々の推測は若山さんがFLS3を作るとき岡部マウスのF1を小保方さんに渡していて、その酸浴細胞核を使ってntESにしたのだとした。だから捏造疑惑から逃れるために、小保方さんが太田ESをどこかで見つけて自分に渡したのだというストーリーにした。だから太田さんから取り寄せたFES1にはFLS3を入れ、学生のGOF-ESにはGLSを入れたのだ。そしてF1に関しては「僕のマウス」を渡したのだと嘘をついたと考えた。
しかし、ここで、若山さんはFLS3をそのまま入れたのではなくて、FLS3もAがリシピエントの別のntESと混ぜている。なぜかということである。
FLSは1-8まである。1は2012/1/31培養開始、2-8は2012/2/2培養開始である。FLS3はワンノブゼムである。ミトコンドリアDNAに関しては3しか調べられていない。そもそもなぜFLS3が全解析を受けたのか。
実はFLS3が全解析されることになったきっかけは最初に丹羽さんが2014/4/17にそれを持ち出して解析したからである。これは若山さんは関与していない。丹羽さんが偶然にこれを選んだだけである。
引っ越しの時に全ライン入れ替えてることになる。どうしてこんなことをしなければならないか。FLSは全部小保方さんがFES1を自分に渡したからだというストーリーにするのはFES1の中身をFLS3に入れ替えるだけでいい。FLS1-8までどうして全部入れ替えなければならないのか。
まして小保方さんはFLSとGLSに関しては自分の株分けした別ラインも持っていて、木星リストに書かれているが、ちゃんと書かれていなくてどこにそれがあるやもしれない。入れ替え犯が一番楽なのは大本を入れ替えてしまうことである。普通はそうする。
だからやはり入れ替えは普通にそうされたのだと仮定する。では、ヘテロプラスミーは最初から5対5でFLS3にあったのだ。
その場合はこのヘテロプラスミーは細胞が単に半々に混ぜられたからではない。
では生殖細胞が作られるときや、Ts.Marker さんが主張している第二次ボトルネック効果によって、Aという偶然にできた卵細胞の変異が卵や初期胚内にコンデンスされてそういう割合になっていたのだということになる。このメカニズムは専門家でもまだ全く分かって無くて、いろんな仮説検証をしている段階です。根拠が弱い。
なんて論理なんだと既知の知識内で専門家の間違いを正すなんてことは簡単で、それは専門領域の話で無くて、一般的良識の問題です。そうでないと裁判官は判決を書けないでしょう。でも、今遺跡を掘っている考古学者に先んじて、何が出るかを言えるど素人はいません。それを専門的領域という。ヘテロプラスミーの問題はまさに今専門家が遺跡にトレンチを入れている状況なんですね。ど素人が固唾をのんで見守っている。
まあ、我々はその道の領域に触れないままでこの事件の解に至れるかどうかを確認するだけのことしかできない。運よくそうであったらこの事件は解決するでしょう。別にヘテロプラスミーの深遠な科学的事実解明がどうなるかとは無関係である。
まず事実がある。FLS3が遺伝子全解析された2014年の7月以降から11月に頃に掛けて、解析サンプルのmtDNAの12188番地のTであるべきローカスにAという変異の有るmtDNAの割合が全体の半分を占めていた。この事実の可能的時系列変化の全てを辿れるかという問題である。まず素人でも分かることはこの変異が16万か所ある中の特定の1か所だけだということだ。他の場所は関係していない。この変異は時系列のどこかでたった一つのミトコンドリア内のたった一個のmtDNAのたった一か所のローカスで起きた。
変異の無いmtDNAとは何か。半分を占めているAでないTのmtDNAである。つまり変異しているAがTであったらすべてのmtDNAは正常なのである。
NOD/ShiLtJではこの場所はAであるのが正常である。Aであるからと言って何か機能障害があるわけではない。その証拠に近交系マウスとして長く維持されている。
今、FLS3に入っているAはマウス系統としてどこかから入り込んだのではないという前提で考えて居る。どこかから入り込んだものが混ぜられた結果半々になったということは無さそうだという結論から、今、突然変異が排除されずに残ったのだという前提で考え直しているのである。核酸の種類は4つしかないのだから変異が偶然Aになることも不思議でもなんでもない。
この変異がいつ入ったのかは分からないが、胎児段階以降に入ったと仮定するとどうなるか。ある細胞にこの変異したミトコンドリアが存在する。これが二つに分裂したときどちらかに変異したミトコンドリアが入る。一方は正常で他方は変異ミトコンドリアを1個含む。細胞質分割をしているから細胞分裂後にどちらの細胞も細胞質を倍に復元する。その時に変異ミトコンドリアを含んでいる方は二個に増える。全体では1個だった細胞が2個に増え、変異している方の変異ミトコンドリア数は2個になる。更に細胞分裂するとどうなるかというと、正常な方の細胞1個は二つに分かれて2個になる。変異しているミトコンドリアを2個含んでいる細胞も二つに分かれるが、この時に二個とも一方に偏ると、半分は正常、もう一つは4個の変異ミトコンドリアを持つ変異細胞になる。つまり、全体では4個の細胞になり、内3個は正常、1個は変異細胞である。これを繰り返すと変異細胞の中の変異ミトコンドリア数は増えていくが、全体の細胞数の下で、この細胞を拾い出す確率はどんどん下がるということが分かる。
他方、2個の変異ミトコンドリアを持つ細胞が一個ずつに分配されて分裂した時はどうなるかというと、全体では4個の細胞は同じであるが、二個が正常で残りの二個の変異細胞はそれぞれ変異ミトコンドリアを2個持つ細胞になる。変異したミトコンドリアの数が全体では4個なのは変わらないことは注意しておくべきである。そして胎児内のこの変異ミトコンドリア数は細胞分裂の度に2のn乗の関数で増えていく。
生体内ではこの変異がいつの時点で発生したかは重要である。というのも胎児の細胞数が相当程度に大きくなっている段階で1個の変異が起きてもこのメカニズムでは全体の中のその時点での割合を超えるということはない。むしろコンデンスされるケースでは割合は減る。
ではこの極端な例として1個の細胞時、つまり卵の中に1個の変異ミトコンドリアがあった場合を考える。この場合は普通の細胞分裂だけを考えると、半分に分割されたときにどちらかに変異ミトコンドリアが入るから、この時点で正常細胞と変異細胞に分かれ、変異細胞内の変異ミトコンドリアは2個になる。ここから細胞分裂を繰り返すと、最大変異細胞数は全体の半分になることが可能で、たぶんそれ以下になることは可能であるが、それ以上には決してなれない。
FLS3が半々であることの原因に近づいてはいるが、まだ十分ではない。なぜなら今はマウス体内での話をしていて、人工的な培養の話ではないからである。
ここまで、そもそもAであることは何の機能障害もないのであるから、成体の生存には関係しない。その証拠にNOD/ShiLtJはAである。ここで上の極端な事例と勘違いしないようにしないといけないが、NOD/ShiLtJはそもそも卵の中の全てのミトコンドリア、或はその中に十数個あるmtDNAの一か所がAなのだということです。どこまで分割されても100%Aになる。これがTと半々になるということがあるとしたら、別のマウス系統の細胞質と混ぜられているからだ。でも、FES3は若山さんは何か別の系統を二つ混ぜたわけではなさそうだということで、今検討している。結構ややこしいので混同しないようにしないといけない。
FLS3の1個の変異がどこで発生したかはまだまだ全然わかっていない。まず胎児段階のどこかで、つまりボトルネック効果の働かない時点での胎児の場合に発生していたらどういうことになるのかという可能性検討で、この変異の広がりの限界が最初の胎児の細胞数との比率を超えないということと、コンデンスされても程度があるということが分かった。なぜこの成体の中でどういう広がり方をするかを確認しておかなければならないかというと、次世代の卵が作られるときにその卵の場所にこの変異細胞がある確率も考えないといけないからである。
実は卵原細胞が出来る場所が決定されるのはとても早い時期で、卵の分割が起こるときに例えば8細胞期に上半分には絶対存在しない。分割が進むにつれてその場所は局所化されていく。例えば、胎児が成体に近くなって心臓にこの変異が入ったとして、それが次世代に引き継がれるということは絶対にないと分かる。心臓があるような場所には卵原細胞はできないのである。心臓近辺に上述したような変異がいくら広がって行っても、その場所が卵細胞になることはない。この変異が卵細胞の直ぐそばで起こる確率がどの程度かはFLS3の半々結果の原因に直結しているのである。
さて、では、FLSはどうやって作られたか。ここにいろんな操作が疑われていて誰の言ってることが正しいのか全く調査されていないから困っているわけである。警察を入れていればこんなところは既に事実関係として確定されているでしょう。でも桂報告は個人の恣意判断だけで推測を書いているだけだ。
科学的解析結果として分かっているのは、核は129/B6-Acr-CAGで細胞自体にはY染色体が存在していて全ライン雄の細胞だとされている。このFLS由来4Nキメラは全部雄なのでジャームライントランスミッション確認するときには兄妹交配ができないので、別の雌をもって来なければならなかった。GFPが半分しかこなかった以前に雌のキメラが居なかったから別の雌を持ってきたんです。この時点で変だと思わない方がどうかしている。自分でわざわざ129の親メスを使って交配実験している。嘘ついてるんです。
渡した赤ちゃんマウスは雌雄取り混ぜている。そのことは論文に書いてあるし、かつ若山さんの記者会見でも本人がそういってる。ところが4Nキメラは全部雄だった。
論文通りに塊でSTAP細胞を培養誘導してSTAP幹細胞を作ったのだとしたら、その細胞は雌雄を半々に含む。それを4Nキメラ胚に入れたら、雌雄半々で入っていますから偶然に生殖細胞に当たったSTAP幹細胞の雌雄確率に従って、つまり、半々に雌雄が生まれるはずですが、8株全部に平均30個もキメラ胚を作って、生まれて成長したキメラトータル26匹全部雄だった。これを不思議にも思わずに、雌が居ないから兄妹交配できないとして、129のメス親と交配した。この時点で既にそれを不思議と思ってないことが分かる。GFPが半分にしか来なかったなんて言い出したのは2012春にヴァカンティが米国特許仮申請を始めようとしていた時期です。そしてそれ以降も実験をそのまま続けている。犯人が誰かなんて我々にはとっくに分かっていることです。繰り返しません。
桂報告書ではこれが全部雄だったのは雄であった大田ESを小保方さんがコンタミさせたからだということになっているわけです。でもこれは何の根拠もない。でも、事実として、FLS1-8は全株雄なんですね。なぜそうなるのか。
論文通りならまずSTAP細胞自体が雌雄半々の細胞集団のはずです。そしてSTAPキメラは作られている。これが既に幹細胞がどうこう言う以前に4Nキメラでも雌雄半々に生まれていないといけない。そして4Nキメラの実験は最初から行われていて、2011/11/28のキメラ写真は4Nキメラでしたね。
ところがジャームライントランスミッション結果は2Nキメラの分しかありません。そしてこれは兄妹交配していますが、2Nだとリシピエントの細胞が生殖細胞になっていると雌も生まれ得るから、ここは4Nキメラのデータがないといけない。ところがそのデータはアーティクルではつけられていないのです。
これは若山さんの意図的な選択です。STAP由来4Nキメラも雄ばかりだったからです。
なぜそうなるのか。
小保方さんは成功したキメラ実験の前にF1のSTAP細胞を渡しています。そしてこれはキメラ成功していない。次にもう一度渡したときにナイフ切り分けで成功したことになった。
この成功した細胞を渡されたときからクローン胚を作っていると10日後のキメラ成功には間に合いません。前回に失敗した時の分を使って同時にクローン胚を作っている。クローンの成功率は低い。たくさん作っています。小保方さんはこの細胞ではキメラはできていませんから、太田細胞なんて入っていない。
クローン胚に入れられた細胞は雌雄半々だったんです。成功率1%です。この中にもいくつかの成功細胞があるので半々に雌雄があったでしょう。そしてこの胚盤胞からESを何ラインか作った。そしてそれぞれのラインを4Nキメラ胚に入れて樹立確認をした。ここでも成功率は2/3でしょうか。うまく成功したラインが雄だけだったということです。
この原ntESが後にSTAP細胞と入れ替えられていくものです。小保方さんの作ったSTAP細胞は廃棄されて、小保方細胞核使用ntES由来のキメラが作られていく。
STAP細胞とSTAP幹細胞は若山さんにとっては同じものです。
小保方さんが自分で作って遺伝子解析に出しているSTAP細胞は若山さんのキメラのできるSTAP細胞=STAP幹細胞とは別ものです。
FLSの核は129/B6-Acr-CAGで細胞自体にはY染色体が存在していて全ライン雄だということは事実ですね。そしてどうしてそうなるかの一つのストーリー説明もした。
仮にntESだったとしたらどうなるかというと、ICRのリシピエント卵の中にこの変異ミトコンドリアがあった場合と、129のドナー卵のミトコンドリアが移植時に持つ込まれた影響と両方考えることになる。
一応、正常な状態ではどちらもTなんですからAはいずれにせよ突然変異で持ち込まれたものということになる。
まずICRの卵の中に既にこのヘテロプラスミーがあった場合です。
動物実験申請書ではICRはマウス業者から購入されている。自家繁殖ではないようです。
流石にマウス業者から買った時はmtDNAは登録データ通りにホモプラスミーで販売されているのではないでしょうか。ここも素人には分からないところです。そんなところまで管理しているのかどうか。でも、管理していなければ登録データには載せられませんからね。そう推測するわけです。
買ったときにはホモプラスミーであったのなら、変異は2011年の実験時以降に発生している。このICRマウスの1個の変異が全体の50%になるということはありませんね。ここでは生殖細胞ボトルネックは経過していない。一度もマウスには戻っていません。クローン胚の中で胚盤胞になり、一度ESになって、更にキメラ胚の中で確認はされたが残っている細胞はそのまま培養されている。従って、この時の変異は培養中に全体のmtDNA総量の50%まで増えたことになる。
正常な細胞が存在している中で無限増殖していくと細胞数で最初の比率のまま増えていくことはあり得ますが、mtDNA総量が半分にまで増えるということはあり得ません。他の細胞の中の正常なmtDNAも同率で増えていく上に、変異ミトコンドリア含む細胞に正常なミトコンドリアが圧倒的に存在している。
この可能性はない。
では、129のドナー側からクローン胚にもたらされたらどうか。この場合でも実験以降にAが入ったとしたら同じです。違うのは、この実験時点で既に129側のヘテロプラスミー率が高かった場合です。マウスで継代されるとヘテロプラスミー率はコンデンスされて高まる卵が出てくる。無論病的な変異であれば卵ごとアポトーシスされるが、このAの一点だけの変異は無害ですからアポトーシス排除はされない。
でも、クローン胚に入れられた時にごくわずかしか入ってないですから、この時点で、一個の卵の中での変異ミトコンドリアの比率は格段に減っている。これが二分割されると一個は正常他方は変異細胞。正常側は常に半分存在していて、残りの変異側から正常細胞が分離されていくので、全体の変異ミトコンドリア数は半分まではとてもいけない。
では太田細胞だったのであればどうなるのか。これはまず太田細胞が何なのか全く厳密な調査を受けていないから分からない。太田さんの言ったとおりに作られていたらterなんでしょ。でもX1だったのならそうでしょうなんて言う証言では何が本当かを確定させて論じることができない。ましてなかったはずだがあったのなら置き忘れでしょうなんて、何を言ってるんだ。国民をバカにしてるのかというレヴェルです。お話にならない。
でも、まあ129/B6-Acr-CAGだったとしましょう。しかも珍しく受精卵ESを目的も無く作った。そして使いもせずにすぐに凍結した。凍結したら細胞は遺伝的に変化しませんからね。ミトコンドリアも固まってじっとしています。で、小保方さんが2011年の11月頃に解凍したということですね。細胞質は129X1ですね。ミトコンドリアのその場所はTが普通だ。この129はどこから持ってきたものなんですかね。市販のものだったらTのホモプラスミーでしょうね。変異は実験後に入ったということですね。一度もマウスにはなってませんね。ESのまま凍結されていた。これが20%の割合にまで増えることはありません。従って、市販のマウスではなく、若山研で自家飼育されていた129で既にヘテロプラスミー割合が高まっていたものということになる。
ところがFES1は2割ですが、同じコロニーの129マウスであるはずのFES2はゼロです。
いろんな可能性を考える以前に人の嘘を確認する方が先でしょうね。これは何らかの人為です。
そしていよいよ、今度は胎児段階ではなく、卵から胚盤胞期、そしてES段階で変異が入った場合です。私の基礎知識は林純一氏の『ミトコンドリア・ミステリー』です。初版が2002/11/20で、現在からみて18年前です。この頃以前に精子のミトコンドリアが遺伝するという説もあって、長い検討の末、精子のミトコンドリアは殺されるということが分かった。この人の功績で、以後、定説は動いていない。ブルーバックスシリーズですから一般教養です。2002年ですらもう一応定説になったことが基本書かれている。発見はもう少し前なんですね。
20年以上経過している。今度Ts.Markerさんが紹介してくれた論文は、Rapid mitochondrial DNA segregation in primate preimplantation embryos precedes somatic and germline bottleneckというタイトルで、2012/5/3がオンライン発行日です。林さんの本からは10年経過している。そしてこの論文自体が更にそこから8年経過している。
ど素人なので今どういう評価なのかは分からない。
参考までにもう一つ「マウスにおけるmtDNA遺伝様式 : 母性遺伝と急調分離」という日本語論文がある。
© 2011 The Japanese Society of Plant Morphology とあって、これもやはり8年以上前である。興味深いのは著者で、設楽浩志, 米川博通氏の共著だが、米川さんは桂報告書に名を連ねているあの人ですね。

ボトルネックのメカニズムそのものが見直されようとしている。
>>
mtDNAコピー数の極端な減少が, ボトルネック効果の原因ではなかったことから, 他のメカニズムによって ボトルネック効果が起こり, 急調分離を成立させている可能性が高い.
現在までに, 我々は2つの遺伝モデ ルを提唱している(Cao et al. 2007). 一つは, 細胞中 のごく限られたmtDNAの集団が選択的に複製される としたモデルである(図3B). 複製されうるmtDNA分 子種が限定されることで, 異質性の割合が規定され, そのまま子孫に伝達された結果, 急調分離が引き起 こされることになる. 実際に前述のカナダのグループ は, 卵の成長過程において一部のmtDNAの集団が 複製されうることを観察し, この遺伝モデルによって急 調分離を引き起こされていることを示している(Wai et al. 2008).
もう一方のモデルが, mtDNAがサブグループ を形成することで, 分離単位の実効数を減少させるモ デルである(図3C). mtDNAはミトコンドリア内でミトコ ンドリア転写因子A(TFAM)やポリメラーゼγ(POLG) などと結合し, DNAとタンパクの複合体(核様体, ヌク レオイド)を形成している(Alam et al. 2003, Bogenhagen et al. 2008). このミトコンドリア核様体には, 2-10分 子のmtDNAが存在しているとされており(Legros et al. 2004), これがサブグループとしての機能を果たしうる. さらに, 哺乳類のミトコンドリアは融合, 分裂, 輸送を 繰り返し(Hirokawa 1998, Ishihara et al. 2003), ミトコン ドリア内の生理活性物質を混合することで, 細胞として はミトコンドリア内の構成成分の均一化されていると考え られているが, ミトコンドリア核様体間でのmtDNAが混合する頻度は比較的少ないことが示されており(Gilkerson et al. 2008), こうしたミトコンドリア動態からもこのモデル の可能性が十分に高いと考えられる.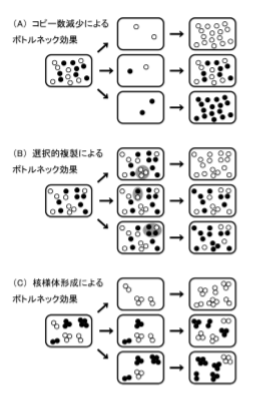
これも8年も経過しているんだから少しは進展して真偽が明らかになっていそうなものですが、何せ素人レヴェルでは分かりませんね。何事も素人は10年遅れですよね。
ともあれ、Ts.Marker さんの紹介論文はES段階でもまだボトルネック効果が発揮されているというんですから重大です。ちょっと検討してみましょう。
>>
Rapid mitochondrial DNA segregation in primate preimplantation embryos precedes somatic and germline bottleneck
Hyo-Sang Lee,1 Hong Ma,1 Rita Cervera Juanes,1 Masahito Tachibana,1 Michelle Sparman,1 Joy Woodward,1 Cathy Ramsey,1 Jing Xu,1 Eun-Ju Kang,1 Paula Amato,2 Georg Mair,3 Ralf Steinborn,3 and Shoukhrat Mitalipov1,2,4,5,*
SUMMARY
The timing and mechanisms of mitochondrial DNA (mtDNA) segregation and transmission in mammals are poorly understood. Genetic bottleneck in female germ cells has been proposed as the main phenomenon responsible for rapid intergenerational segregation of heteroplasmic mtDNA. We demonstrate here that mtDNA segregation occurs during primate preimplantation embryogenesis resulting in partitioning of mtDNA variants between daughter blastomeres. A substantial shift toward homoplasmy occurred in fetuses and embryonic stem cells (ESCs) derived from these heteroplasmic embryos. We also observed a wide range of heteroplasmic mtDNA variants distributed in individual oocytes recovered from these fetuses. Thus, we present here evidence for a previously unknown mtDNA segregation and bottleneck during preimplantation embryo development, suggesting that return to the homoplasmic condition can occur during development of an individual organism from the zygote to birth, without a passage through the germline.米川さんの論文は林さんの教科書的記載に対して、まずボトルネックはそんなに数は減って無いと主張した。だからメカニズムがどうも教科書的知見と違うと指摘している。対して、Ts.Markerさん紹介論文では、ボトルネック効果の起こる時期が違うと言ってる。米川さんのところの日本語用語では急調分離ですか。英語ではRapid segregation となってるから、どちらの論文も同じ現象を言ってる。前者はメカニズム、後者は時期ですね。
Figure1です。
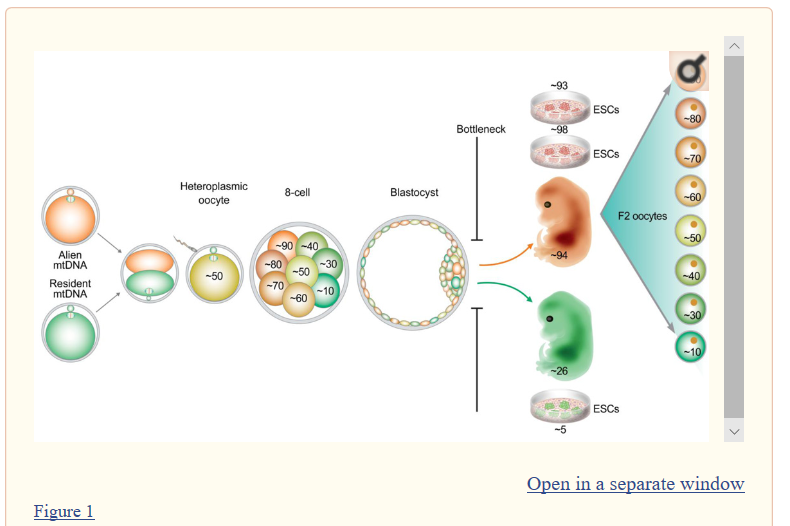
ボトルネックと言うのは卵母細胞の時点で起こるとされていたのを否定した。まず緑色の既にできている卵に対して細胞質を半分取り除いて別の種類の細胞質を注入する。一個の卵の中に二種類のmtDNAが入るのでヘテロプラスミーになる。PCRにかけてほぼ半々であることを確認している。
これと似たようなPCR結果が、上述している、二種類のサンプルを混ぜたケースである。違いは1個の細胞か、たくさんの細胞かの違いだけである。
ともあれ、この実験では卵母細胞の発生時期にのみボトルネックが起きるのではないということの1ケースを実証した。図では卵の大きさは8細胞期で拡大されているが、胚盤胞期までほとんど同じ大きさである。ハッチング前に卵の外側の膜が柔らかくなって水分を吸い取ってやや大きくなった後に殻を脱ぎ捨てて着床する。
8細胞期なんてそもそも大きさは変わっていない。中を分かりやすくするために拡大表示しているだけである。ここは勘違いしないようにしなければならない。分割球の一個ずつはどんどん小さく分割されていくのである。つまり胎児段階の体細胞分裂と違っては半分に細胞質がなったあとに倍には戻らないで、そのままどんどん容積が小さくなっていくだけである。
従って胚盤胞期の各細胞は小さすぎで個別解析はされていない。出来なかったと書いてある。8細胞期までを調べたのである。
その結果8細胞期の図にあるように、8個の細胞はヘテロプラスミー率がすべて50%に均等に分裂したかというと、そうではなくて全部がホモになろうと努力していたことが分かったということである。この胚盤胞期に至る発生期においてもボトルネックによる急調分離が起きているという証明である。
しかもこの段階ではミトコンドリア数は昔謂われていたように数は減っていない。ランダム選択説はこの発生期の急調分離メカニズムとしては通用していないという。つまり米川さんの論文と同じことを指摘しているようだ。要するにボトルネックのメカニズムはまだ分かってないということで、ここでは何か別のメカニズムがあると示唆している。
でも、要する分かってないということです。プロがまだ分かってないことに素人があれこれ論じても意味がないですね。せいぜい、発生期でもまだmtDNAはホモプラスミーに揃おうとしているらしいということを確認できればいいのではないか。つまり分かってないところは断定するなということです。
ES細胞になってから培養中にまだホモプラスミーに揃おうとしているのであろうか。分かっていないということです。
(Ts.Markerさんの問い)以下、Ts.Markerさんの疑問であった。
>>
heteroplasmy の違いから - ni -
2020年1月24日
ミトコンドリア病(ヘテロプラスミー)についての情報は近年かなり豊富なようだ。暇に任せ調べていくうちにヘテロプラスミーの比率を変化させるもう一つの知見があった!
それは卵子形成時のボトルネック効果によるヘテロプラスミー割合の変動のみならず胚盤胞(Blastocyst)期でもボトルネック効果があるという。
卵子形成時の早期ボトルネックに対し胚盤胞期のボトルネックは後期ボトルネック(second bottleneack)と呼ばれヘテロプラスミー比率の変動が報告されている。
初期の論文「Rapid Mitochondrial DNA Segregation in Primate Preimplantation Embryos Precedes Somatic and Germline Bottleneck」
イメージ(https://www.lifescience.mext.go.jp/files/pdf/n2132_06.pdf#search=%27blastocyst+bottleneck%27)
例えば、ヘテロプラスミーをもつFES1の株分けらしい129/GFP ESを4倍体胚盤胞にインジェクションし4Nキメラマウスを得る。その4Nキメラマウスを筆頭著者に渡していたらsecond bottleneckによりヘテロプラスミーの比率はばらつきFES1,129/GFP ESとは違ってくるだろうということは容易に想像できる。Aの比率が増えたり(FLS3) Tの比率が増えたり(FLS1) ホモプラスミーになったり(CTS1)...。
エアF1マウスを渡されていたんじゃないか...。①例えば、ヘテロプラスミーをもつFES1の株分けらしい129/GFP ESをFES1の中身が太田さんの作ったものか否かは問わず、桂報告書が分析したFES1という意味で、129/GFP ESはその株分けだと。
②4倍体胚盤胞にインジェクションし4Nキメラマウスを得る。若山さんがなぜそんなことを当時しなければならなかったのかの状況説明が何も書かれていないが、仮にそうしたとして、その129/GFP ESの4Nキメラは簡単に作れる。
③その4Nキメラマウスを筆頭著者に渡していたらsecond bottleneckによりヘテロプラスミーの比率はばらつきFES1,129/GFP ESとは違ってくるだろうということは容易に想像できる。その4Nキメラ胚にES細胞を入れたらsecond bottleneckが必ず起こるのなら、生まれてきた4Nキメラマウスはそれぞれすべてヘテロプラスミー率が違うであろうが、キメラ実験した結果は論文には書かれていないので推測に過ぎない。
④Aの比率が増えたり(FLS3) Tの比率が増えたり(FLS1) ホモプラスミーになったり(CTS1)...。
事件化する前に若山さんが太田ESとされている細胞及びその株分け細胞を使って4Nキメラを作っていて、この赤ちゃんマウスを渡して小保方さんに酸浴細胞を作らせていたが、成功せず、次にナイフ切り分けで、キメラができ、幹細胞かもできたと。若山さんは最初にどうしてそんな複雑なことをしなければならなかったのでしょうか。どうして岡部マウスと129のF1を渡していたと考えてはいけないのでしょうか。
それだと事件化後に発見されたmtDNAの変異箇所の説明がつかないからですね。でも、よく考えてください。FES1も129/GFP ESもラボにはなかったもので、小保方さんが置忘れを見つけたとされているのではないですか。それなら若山さんはそんな4Nキメラは作りようがない。
逆に若山さんがそのF1の細胞を持っていたのだとしましょう。そのような4Nキメラの赤ちゃんマウスを渡していたのだとしましょう。それでも小保方さんはそのマウスの体細胞を酸浴させてSTAP細胞を作って若山さんに手渡した。最初できなかったが、次にナイフで切り分けてできた。そして幹細胞もできた。これって大成功ではないですか。どうして若山さんが論文取り下げに躍起にならなければならないのでしょうか。これって元が何であれ、体細胞リプログラミングの証明です。太田ESから作られた4Nキメラマウスを使ったからと言って、実験結果に何の影響もない。
しかも、再現実験でキメラはできなかった。
⑤エアF1マウスを渡されていたんじゃないか...。(⑤エアF1マウスを渡されていたんじゃないか...。)Ts.Markerさんは"エアF1"という言葉を使う。
>>
0. Zscan4
2020年01月21日 14:40
>>8
>..の部分は中身の話ですね。
相変わらずかみ合わないね。
129/GFP ES を起こして、インジェクションし4Nキメラの129B6マウスを生ませる。(エアF1)まずエアの意味が分からない。
エアギターというのは本物のギターは無いのにそれを演奏している形態模写を言うから、エアF1というからには本物のF1ではなく、偽物のF1だという意味なのであろう。マウスを掛け合わせて生まれた子供がF1マウスだとするとそのESもF1ESなので、とても紛らわしい。しかし、常識的に解釈して、エアF1というのは生きているマウスなのであってESではないという意味なのは明確だ。従ってエアF1とTs.Marker さんが揶揄しているのは、マウスだと思わせといて実際には盲点になっているが、ES細胞を使ってるだろうという批判ですよね。
ここまではいいんですね。
問題は、どうしてES細胞だと思うのかというところです。ES細胞から作った4Nキメラじゃないかと考えるのは自由なので、その可能性を追うのは構わないが、そうであったら、この事件のどこがどう変わるのかの説明が全くないから理解できない。噛み合ってないのではなくて、説明を受けていないから分からないということですね。
どこかで、説明が書かれているのならそこを指定してくれたら読むが、一応Ts.Marker さんのブログは全部チェックしている。事件を概括している説明はないはずである。この辺りは和モガさんと対照的だ。しかし、Ts.Marker さんの示唆している推測できる概括は和モガさんのと違うようだ。
(推測できるTs.Marker さん説)誰でも知っている通り、Ts.Marker さんは和モガさんと並んで早くからの桂報告書の批判者です。どちらもどうやら理系の人らしい。どの程度このSTAP関連の専門に近いのかは分かってない。和モガさんはいち早くFES1とFLS3が=であるということはどちらが先であったか、つまり太田ESでFES3が捏造されたのか、逆にFLS3で太田ESが捏造されたのかの証明にはなっていないと指摘した。
Ts.Markerさんは、SNP解析が変だと指摘し、FI-SCのOct4-GFPは光ってるじゃないか等々と、最初から細かい疑念を提出した。私はど素人なので、桂報告を読んだ時は感心して、なんだこんなに細かく分析してるんなら、簡単に犯人は分かるはずだと思った。特に何度もES細胞でコンタミさせている結論になってるのに意図的コンタミであるかどうかも分からないなんて、頓珍漢な話なので、これは裏があつてわざと結論を曖昧にしているのだと直感した。その時はむしろ小保方さん犯人だろうと思っていた段階だった。
一般人としては、まずは何かの勘違いだ。次はNHKを見て中国人のスパイじゃないか。そして、次は若山さんの記者会見を見て、奥さんを庇ってるのかとも思ったが、桂報告最初に読んだ時は小保方さんだと分かったのだなと推測した。だからわざと結論をぼかしていると考えて、小保方さん犯人説を確定させてやろうと考えた。できなかった。どうしてもおかしい。そして手記が出た。ここにリクルートの問題が絡んでいたと知った。
①キメラは論文通りにできた。(和モガ、Ts.Marker説)
②キメラは小保方さんのESコンタミ捏造である。(桂報告書結論)
③キメラは小保方さんの成功を妬んだ第三者が以後妨害コンタミを続けた。(和モガ説)
④キメラは若山さんの小保方核使用ntESによって作られ、リクルート上の都合で一時的嘘をついたもの。(居士説)
⑤キメラはできていて、幹細胞化は共培養によるもの。(Ts.Marker 説)
和モガさんは①③
①キメラは論文通りにできた。(和モガ、Ts.Marker説)
③キメラは小保方さんの成功を妬んだ第三者が以後妨害コンタミを続けた。(和モガ説)
Ts.Markerさんは①⑤
①キメラは論文通りにできた。(和モガ、Ts.Marker説)
⑤キメラはできていて、幹細胞化は共培養によるもの。(Ts.Marker 説)
居士説は④
④キメラは若山さんの小保方核使用ntESによって作られ、リクルート上の都合で一時的嘘をついたもの。(居士説)
桂報告書説は②
②キメラは小保方さんのESコンタミ捏造である。(桂報告書結論)
STAPキメラに関して分類すると
A.キメラは論文通りできた。
和モガさん、Ts.Markerさん
B.キメラは論文通りにはできてない。
桂報告書、一言居士
STAP幹細胞に関して分類すると
A.幹細胞は論文通りにできた。
和モガさん
B.幹細胞は論文通りにはできてない。
桂報告書、Ts.Markerさん、一言居士
Ooboe さんから私の和モガ説批判を再掲してくれとの依頼がコメント欄にあるが、先にTs.Marker 説から検証する。(Ts.Marker説構築)和モガさんはこの事件をきれいなフローチャートに纏めてくれているので、推測の流れがとても良く分かって批判もしやすい。Ts.Marker さんは何か故あって正体を知られたくないのか、多くを語らない。ほとんど仄めかしなので、これでは第三者が理解するのは難しい。しかし、多く語ると文は人なりと言って人間性がでてしまうので、人それぞれ都合があろうから、それをとやかく言っても仕方ない。
しかし、「相変わらずかみ合わないね。」という言葉の裏には噛み合っ欲しいという希望は見えるので、推測してもらいたいという意味であろう。推測してこれでいいんですかと問うても答えないという方針なのは分かっているので、甲斐がないこと甚だしいが、ただ、言葉の端々を繋いで全体を構築しておいてみる程度のことは出来る。
今まで一番彼が自分の推測を語ったのは共培養の件である。
>>
23. Zscan4
2019年12月15日 21:23
>>22
論文通りでは、幹細胞は再現できなかったと筆頭著者さんが手記に書いている。
別のプラスアルファーがあったんじゃなかろうかと。
「ESやTSとの共培養による幹細胞への誘導」
あの日に書かれた3T3細胞のくだりを覚えている?
共培養により他の細胞からの因子を受けて増殖する話。
和モガさんも乗ってくれたが、他の方のアドバイスも頂いた。
ESやTSとの共培養は非常にリスキーだと(DORAのブログ参照 気まぐれ先生より)
幹細胞に駆逐され入れ替わる場合もということ。
また後のソートも難しい、10%ぐらいTS(CD1)が残ったというのも考えられるんじゃない。まず彼はキメラは論文通りできていると考えて居る。ただ、幹細胞は小保方さんに出来なかった。だからここで若山さんが論文に書かれていない手技を使ったのだ。それがESとの共培養だと考えて居る。TSのことはともかくとして、ここまでは最初のキメラ成功時に行われた結果を説明していることにならないといけない。
リスキーではあっても、成功したから幹細胞もできたと言った。ここで、彼がヘテロプラスミーに関して推測したことを加えると、最初に成功したキメラマウスの由来細胞は大田ESだということになる。
まず若山さんは後に桂報告書で太田ESとかFES1と呼ばれた細胞の元を持っているのでないといけない。次にこのES細胞を使って4Nキメラを作った。そして小保方さんに129B6F1マウスだと言ってその赤ちゃんマウスを渡した。
①129xB6-Acr-CAGF1ESから作られた4Nキメラ赤ちゃんマウスである。
②129xB6-Acr-CAGF1の自然発生マウスである。
どちらかということになるが、どちらであっても小保方さんはそれを酸浴させてSTAP細胞を作る。形態判断でそのスフィア塊を若山さんに渡す。若山さんはナイフカットして2Nと4Nキメラ胚にインジェクトする。数百個のインジェクションを行う。
キメラはそれでできた。4Nキメラの帝王切開胎児が2011/11/28に取り出された。4Nの方が良く光るので見栄えがいいから4Nが取り出された。2Nマウスは自然発生させたのであろうか。その場合は更に10日後の2011/12/10ごろになるが、論文にはこの写真はない。2011/11/25にはGLが樹立開始されている。キメラが成功しているか否かは4Nキメラのリシピエントのお腹が膨れてきたら2011/11/28以前に分かるので、GOFでも幹細胞化を試したのだと分かる。この時のGOFのキメラ実験が行なわれたのか否かも発表されていない。若山さんの実験ノートはすべて提出されていたはずである。しかし、GLの検査すらされていないのであるから、キメラに関しても触れられていない。GOFのキメラは作られていたとしたら、2011/11/25のキメラ胚から作るとされた幹細胞と同時期の異色のはずなので、帝王切開なら2011/12/5頃、自然出産は2011/12/15頃になる。因みに小保方さんは12/10から12/18まで渡米しているので自然出産に立ち会ってはいないことになる。
私はキメラができたのも幹細胞ができたのもntESだと思っているが、Ts.Marker さんはキメラはナイフ切り分けでできた。幹細胞は一旦キメラ胚の中に入れただけでリシピエントのインナーセルマスとの共培養になるのでそれでできたと言ってるのか、キメラ胚に入れた時にES細胞とSTAP細胞を両方入れたのか、或は、キメラ胚には入れずに単に培養皿の上で共培養したものをFACS選別したら増殖し始めたのか、といった、細かいことの説明が無いのではっきりしない。しかし、以下の記述は培養皿の上ということなのであろうか。
>>
ESやTSとの共培養は非常にリスキーだと(DORAのブログ参照 気まぐれ先生より)
幹細胞に駆逐され入れ替わる場合もということ。
また後のソートも難しい、10%ぐらいTS(CD1)が残ったというのも考えられるんじゃない。最後のソートに関してはGFPの有無でソートするので大して難しくないと思うが。
ともあれ、小保方さんはGOFの赤ちゃんマウスと12/27検収のヌードマウスを使って、休日出勤してテラトーマを作り、その後渡米した。そして翌年に帰ってきてそのテラトーマを切り出して3誌論文に使わずにいたら、後の事件化後の検査でアクロシンが出た。
私は若山さんが幹細胞と称するntESを上から注射したからだと説明しているが、Ts.Markerさんはその説明がない。彼の説では共培養でできた幹細胞を注射したと説明すると、私と同じ説明がつくが、私と彼の説の違いは、彼はキメラは論文通りに出来ていると考えて居る。ならばどうして若山さんは幹細胞を注射したのか。そのままで出来るかどうかまずは自分でも確認したいのではないか。
私の説はキメラはntES化したからできたのであるから、小保方さんの酸浴細胞でテラトーマを作っても簡単に出来る筈はない。酸浴でとても光るようになったから、ティシュー論文や博論とは違ってできがいいはず、ましてキメラもできていると小保方さんは期待している。リクルートのための時間稼ぎの嘘に過ぎないのだから、ちょいと注射したと解釈している。Ts.Marker さんの推測ではそこの説明がうまくいかないのではないか。
(Ooboe さん要望の和モガ説批判再掲)和モガさんの説明はとてもクリアなので理解しやすい。まずは有名なフローチャートを貼り付けましょう。
カテゴリーの「STAP細胞事件(90)」をクリックして下までスクロールして5回ページをめくると出てくる。
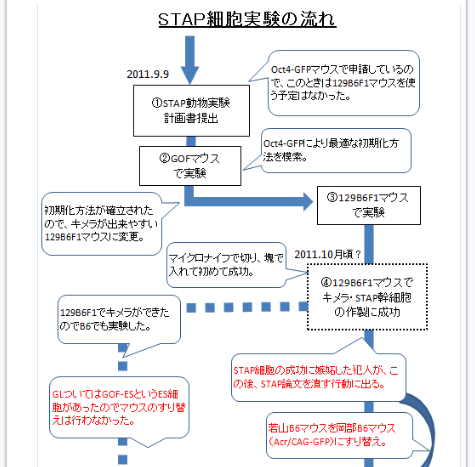
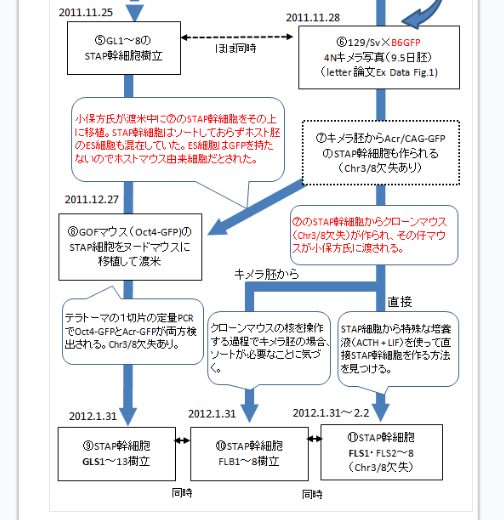
自分のブログを持つと図が使えるので説明しやすいですね。まず2011/9/9付の動物実験申請書は以下です。

途中省略します。
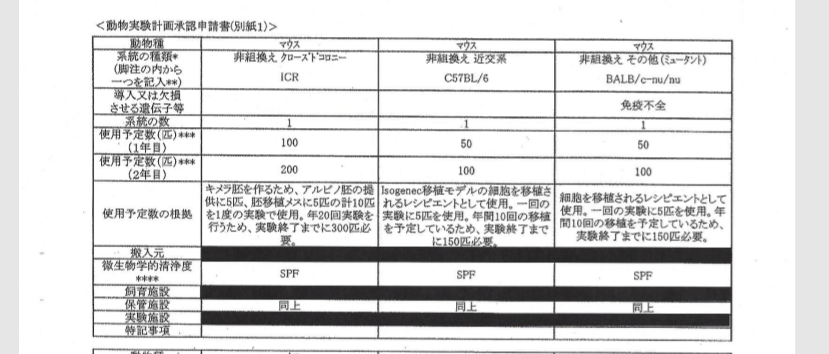
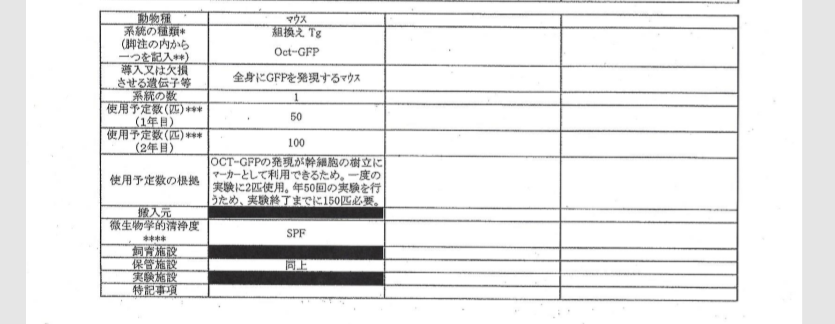
ICRはキメラのリシピエントマウス。B6とヌードマウスはテラトーマのリシピエントマウス。GOFマウスはSTAP細胞のドナーマウスで無論、若山研で自家飼育している分です。
和モガさんが書いているようにまだこの時はキメラ実験はしていませんからF1マウスの申請はしていない。あくまでもGOFマウスでキメラ実験する予定です。で、このことは手記にしか書かれていないことですが、GOFマウスでは失敗した。B6はESでも作りにくいマウスなのでF1でやってみようということになって、それで作ってみたら、又失敗した。
>>
2011年10月頃には、ATPに細胞を晒すことが試みた中では最も適したストレス条件であることもわかり、明るく光る(つまりOct4が強く発現している)細胞塊が観察されるようになっていた。顕微鏡下で見てもらうと、若山先生も「うん、ちゃんと光ってるね」と言ってくださった。こうして、「ちゃんと光る細胞塊」を確認してから、若山先生がキメラ作製の実験に力を入れてくださるようになった。(89P)
ここにまず時期の情報がある。キメラ実験の準備は2011年10月頃にちゃんと光る細胞塊が出来るようになった後である。和モガさんはこの手記の記載をしっかり確認していない。
①STAP動物実験計画書提出(2011.9.9)-Oct4-GFPマウスで申請しているので、この時は129B6F1マウスを使う予定はなかった。
②GOFマウスで実験-Oct4-GFPで最適な初期化方法を模索。-初期化方法が確立されたので、キメラが出来やすい129B6F1マウスに変更。
③129B6F1マウスで実験
④129B6F1マウスでキメラ・STAP幹細胞作製に成功。(2011.10月頃?)-マイクロナイフで切り、塊で入れて初めて成功。
ここまでの段階で既に日程が違っていますね。最初のキメラ成功は11月だと自己点検委員会の報告にもある。又、4Nキメラの写真の日付は2011/11/28です。10月頃に光ったというのは曖昧なので9月の後半まで含んでいてもいいでしょうが、光ってから準備を始めたと手記に書いてある。その時系列は以下の通りです。
>>
キメラマウス作製のためには卵の準備、スフェア細胞の準備、キメラ胚を移植するお母さんマウスの準備のすべてを、タイミングを合わせて行わねばならない。若山先生が計画表を作成してくださり、いよいよキメラマウス作製実験が本格的に始まった。しかし、何度試みていただいたものの、やはりES細胞から作製されるようなキメラマウスはできてこなかった。(90P)
計画表から作製したと書かれている。小保方さんはそれを見ている。そしてその計画表通りに実験は行われ、小保方さん自身も計画表の日程通りに酸浴細胞を作成したのです。小保方さん本人が確認したことを書いている。ここで何日かかったかが計算できる。
①計画表の作製は1日
②GOFマウスの赤ちゃんマウスを得るのに交配から始めて最低20日。
③酸浴細胞を作るのに最低7日。
④キメラ胚を得るのに交配から始めて4日。
⑤仮親の疑似妊娠状態を作るのに2日程度。
⑥キメラが生まれるまで移植後16日。
この6つの作業を同時並行に行って経過する最長時間は①③⑥の合計です。
約25日以上ですね。②は何時も準備されているから小保方さんはすぐ酸浴細胞の作製を始められるのです。そしてそれを受け取ってからでないと若山さんはキメラ胚インジェクションはできませんが、キメラ胚自体は酸浴細胞がインキュベーターの中にある7日間の間にジャストインタイムで作っておけばいい。仮親も同じです。インジェクトしたら1日休めてから仮親の子宮に入れる。そこから生まれるまで20日から4日を引いた16日です。
何度か試みたと書いてある。インジェクションは一日で終わってない。2,3日かけている。だからほぼ1か月かかっている。10月1日に始めたら11月1日に出来なかったという結果が出るのです。10月頃に光ったと書いているが、これが9月の20日だったら10月の20日ころに失敗確認ができたということになる。
和モガさんの以下の時系列認識はちがっていますよね。まだ成功してない。
>>
④129B6F1マウスでキメラ・STAP幹細胞作製に成功。(2011.10月頃?)-マイクロナイフで切り、塊で入れて初めて成功。
小保方さんの手記の続きを確認しましょう。
>>
私はもうES細胞からのようなキメラマウスはできないというのも重要な結果の一つと捉え、分化した体細胞がストレスを受けるとOct4陽性の細胞塊ができてくるまでの細胞の変化過程を論文化しようと考えていた。GOFのスフィア塊からはちゃんとしたキメラは出来なかった。博論時のキメラのようなGFP細胞が何個が死なずに残っているようなのではなくて、ES細胞からできるようなスタンダードなキメラは出来ないと確認したということです。これが早ければ10/20頃、遅ければ10月の末か1日ころだということになる。
ところがここからF1マウスでの実験が始まったのです。手記の続きを確認しましょう。
>>
ところが若山先生はどうにかスフェアからキメラマウスを作製する方法を思案してくださっていた。イヌに多種の血統があるようにマウスにも多種の系統があり、実験結果が安定するように各系統のマウスの系統は厳密に管理されている。ここは近交系マウスの説明を若山さんから受けたんでしょうね。F1でやってみることになる前振りです。小保方さんはGOFでできなかっただけであきらめたのですから、そういうことは知らなかったでしょう。手記は続きます。
>>
ある日、若山先生から、「ES細胞にはES細胞が樹立しやすい系統のマウスと樹立が難しい系統のマウスが存在している。また、クローンマウスを作製するときにも、クローンマウスを作りやすい系統のマウスが存在しているから、その系統のマウスを使って小保方さんのキメラマウスの作製を行ってみたい」とご提案いただいた。ここの記載は注意深く読んでいただきたいが、若山さんはクローンマウスを作りやすい系統のマウスを使って小保方さんのキメラマウスを作成したいと言っている。小保方さんの細胞でクローンマウスを作るのだとも聞こえる言い方ですね。
何か、小保方さんを教育でもしているような言い方にもなっている。気になるところです。彼は小保方さんを一度リクルートしようとしてヴァカンティに反対されている。本当なら小保方さんを受け入れなければいいだけですが、その後も引き続きGOFマウスを使わせるという名目で彼女を客員受け入れしている。小島さんまで名目上の客員にしている。
私の説だと若山さんはここで小保方核使用ntES実験に切り替えたということになるんですが、今は和モガさんの仮説検証ですから、ここでは言わない。続きです。
>>
若山先生が準備してくれたマウスは129xB6 F1と呼ばれるマウスで、129という系統のマウスとB6という系統のマウスを交配させて作製した雑種の赤ちゃんマウスだった。
今回のキメラ実験は、まず雑種の赤ちゃんマウスの準備、そのマウスを使ったスフェア作製の日程の決定、卵の準備、移植するお母さんの準備をすべて若山先生が計画し準備してくださった。キメラ実験を行う1週間前に若山先生から赤ちゃんマウスを渡され、スフィアを作成してキメラ実験用に若山先生に渡すように指示を受けた。何度か繰り返し実験を行ったが、やはりキメラマウスはできてこなかった。それにもかかわらず、若山先生はあきらめずに実験を繰り返してくださった。どうでしょうか。キメラマウスが出来てこなかったと確認できたのは計算上何時頃になるでしょうかね。計画に1日、F1マウスの交配から始めて赤ちゃんマウスを得るのに最低でも20日かかる。そこからスフィア作成に7日かけて移植に1日、そして1日休めて、子宮に移す。そこから最低でも16日で出産。仮に10日胚で帝王切開するとしても、6日かかる。計35日です。前回のGOFでの失敗確認が早くて10月20日ころでした。11月25日ころに帝王切開して失敗確認したということになる。さて、続きです。いよいよ成功しますね。
>>
ある日いつもの通りスフェアを渡すと、「これまではスフェアをバラバラの細胞にしてから初期胚に注入していたが、今日からはマイクロナイフで切って小さくした細胞塊を初期胚に注入してキメラマウスを作ることにした」とおっしゃった。それから10日後、若山先生からキメラができたと連絡を受けた。その上。残りの細胞をES細胞樹立用の培養液で培養したらES細胞様に増えだしたと報告された。毎日、スフェア細胞を培養し観察していた私は、細胞が増える気配すら感じたことがなかったので大変驚いた。「特殊な手技を使って作製しているから、僕がいなければなかなか再現がとれないよ。世界はなかなか追いついてこられないはず」と若山先生は笑顔で話していた。私の説では若山さんはいたずらしているので笑顔だったと自然に理解してますけどね。まあ、ここでは和モガ説批判ですから控えて置きましょう。
F1での最初の実験結果が失敗だと確認できたのは11月25日前後だという計算になっていましたね。でも記録に残っている最初のキメラは11月28日の4Nキメラです。10日の胎児だとして、ここから小保方さんの説明している経緯を逆算して行けます。
11月28日 10日胚の帝王切開、蛍光顕微鏡撮影
11月27日 9日胚
11月26日 8日胚
11月25日 7日胚
11月24日 6日胚
11月23日 5日胚
11月22日 4日胚 仮親子宮への挿入
11月21日 4日胚 一日培養
11月20日 4日胚 リシピエント胚盤胞へのスフィア細胞移植(今日からナイフ切り分け)
11月19日 7日目 インキュベーター内
11月18日 6日目 インキュベーター内
11月17日 5日目 インキュベーター内
11月16日 4日目 インキュベーター内
11月15日 3日目 インキュベーター内
11月14日 2日目 インキュベーター内
11月13日 1日目 F1マウスATP酸浴
記録に残っている最初のキメラの赤ちゃんマウスを小保方さんが受け取ったのは11月13日です。そしてこれは成功したキメラですから、失敗しているキメラ実験はこれより前の段階で渡されている。小保方さんはF1でやることになってからはずっと赤ちゃんマウスを渡されつづけていて毎日スフィア酸浴をしているからこの時期はずっと若山さんに細胞を提供し続けることができる。
小保方さんは以下のように書いている。
>>
何度か繰り返し実験を行ったが、やはりキメラマウスはできてこなかった。それにもかかわらず、若山先生はあきらめずに実験を繰り返してくださった。キメラが出来てこないがあきらめずに実験を繰り返していたが11月20日にはナイフ切り分けでやると言った。つまり以前の結果が出来てないからです。前日作っているのはまだ結果が出てないかもしれないが、前日までに結果が分かったものに関しては出来てなかったから、11月20日にナイフ切り分けと決めた。最後に出来てないと判断したキメラに移植したスフィア細胞は11月12日に小保方さんが酸浴させたものということになる。するとこれより数日前までは失敗続きだったのだから、11月5日頃から小保方さんはF1マウスの赤ちゃんを受け取っていたことになる。
もう一度日程を確認してみよう。今度は逆算でなく10月1日を起点にしてみる。
10月1日 GOFキメラ作製計画書作製。
10月2日 GOF赤ちゃんマウスATP酸浴
10月3日 インキュベーター1日目
10月4日 インキュベーター2日目
10月5日 インキュベーター3日目
10月6日 インキュベーター4日目
10月7日 インキュベーター5日目
10月8日 インキュベーター6日目
10月9日 インキュベーター7日目
10月10日 リシピエント胚盤胞胚へスフィア細胞移植
10月11日 リシピエント胚盤胞胚一日培養
10月12日 リシピエント胚盤胞胚を仮親子宮に挿入
10月13日 キメラ5日胚
10月14日 キメラ6日胚
10月15日 キメラ7日胚
10月16日 キメラ8日胚
10月17日 キメラ9日胚
10月18日 キメラ10日胚
10月19日 キメラ11日胚
10月20日 キメラ12日胚
10月21日 キメラ13日胚
10月22日 キメラ14日胚
10月23日 キメラ15日胚
10月24日 キメラ16日胚
10月25日 キメラ17日胚
10月26日 キメラ18日胚
10月27日 キメラ19日胚
10月28日 キメラ20日胚自然分娩
10月29日 1日遅れキメラの自然分娩
10月30日 2日遅れキメラの自然分娩
10月30日 3日遅れキメラの自然分娩
10月31日 4日遅れキメラの自然分娩
11月1日 5日遅れキメラの自然分娩
11月2日 F1マウスキメラ作製計画書
11月3日 F1マウス交配
11月4日 F1マウスプラグ確認(妊娠確認)
11月5日 F1マウス妊娠2日目
11月6日 F1マウス妊娠3日目
11月7日 F1マウス妊娠4日目
11月8日 F1マウス妊娠5日目
11月9日 F1マウス妊娠6日目
11月10日 F1マウス妊娠7日目
11月11日 F1マウス妊娠8日目
11月12日 F1マウス妊娠9日目
11月13日 F1マウス妊娠10日目
11月14日 F1マウス妊娠11日目
11月15日 F1マウス妊娠12日目
11月16日 F1マウス妊娠13日目
11月17日 F1マウス妊娠14日目
11月18日 F1マウス妊娠15日目
11月19日 F1マウス妊娠16日目
11月20日 F1マウス妊娠17日目
11月21日 F1マウス妊娠18日目
11月22日 F1マウス妊娠19日目
11月23日 F1マウス妊娠20日目出産11月24日 F1赤ちゃんマウスATP酸浴
11月25日 インキュベーター内2日目
11月26日 インキュベーター内3日目
11月27日 インキュベーター内4日目
11月28日 インキュベーター内5日目
11月29日 インキュベーター内6日目
11月30日 インキュベーター内7日目
12月1日 リシピエント胚盤胞胚へスフィア細胞移植
12月2日 リシピエント胚盤胞胚一日培養
12月3日 リシピエント胚盤胞胚を仮親子宮に挿入
12月4日 4Nキメラ5日胚
12月5日 4Nキメラ6日胚
12月6日 4Nキメラ7日胚
12月7日 4Nキメラ8日胚
12月8日 4Nキメラ9日胚
12月9日 4Nキメラ10日胚 帝王切開胎児確認
12月9日 1日遅れ4Nキメラの帝王切開確認
12月9日 2日遅れ4Nキメラの帝王切開確認
12月9日 3日遅れ4Nキメラの帝王切開確認
12月9日 4日遅れ4Nキメラの帝王切開確認
12月9日 5日遅れ4Nキメラの帝王切開確認
12月10日 今日からナイフ切り分け、リシピエント胚盤胞胚へスフィア細胞移植
12月11日 リシピエント胚盤胞胚一日培養
12月12日 リシピエント胚盤胞胚を仮親子宮に挿入
12月13日 4Nキメラ5日胚
12月14日 4Nキメラ6日胚
12月15日 4Nキメラ7日胚
12月16日 4Nキメラ8日胚
12月17日 4Nキメラ9日胚
12月18日 4Nキメラ10日胚 帝王切開胎児確認成功(記録では2011/11/27)
つまり記録されているキメラのできた2011/11/28日付が最初のキメラだとすると21日合わないことになるので、スタートの10月1日仮定を9月9日に修正すればいいことになる。小保方さんが10月頃に良く光るようになったと書いているのを9月の前半だったと解釈する。
もしくは、一番自然なのはF1マウスを1から作ったかということを疑えばF1マウスは既に用意されていたのだと考えて、小保方さんが疑っていないから、早すぎると気付かなかったと考える。最大20日縮まることになる。これだとぴったり合うことになる。
(和モガ第三者説批判)ここまで日程を押さえた上で和モガさんのフローチャートを検証してみよう。

最初の段階で既に無理があると分かる。2011.10月頃という記述が既に最初のキメラは11月だという理研の発表と整合していない。レターの写真が2011/11/28撮影のキメラだという理研の説明も考慮されてない。
ただし、あくまでも?マークなので、既述した日程で小保方さんの勘違いで9月9日に良く光って、かつF1は既に準備されていたと考えると21日と20日で41日早まる。すると12月18日から41日遡ると、11月7日になる。ここで11/28のキメラ以前に最初のキメラが出来ていたのだと考えることもできる。桂報告書と若山さんは11/28のキメラが最初のキメラとは言ってない。ただ11月に最初のキメラが出来たと言ってるだけなので、11/7から11/28までの間に最初のキメラがあった可能性はある。
さて、やっとOoboe さんのご要望に応えて、和モガ説批判を述べることが出来る準備が整った。2011.10月頃?は11/7~11/28と読み替えましょう。もう一度確認します。
①STAP動物実験計画書提出(2011.9.9)-Oct4-GFPマウスで申請しているので、この時は129B6F1マウスを使う予定はなかった。
②GOFマウスで実験-Oct4-GFPで最適な初期化方法を模索。-初期化方法が確立されたので、キメラが出来やすい129B6F1マウスに変更。
③129B6F1マウスで実験
④129B6F1マウスでキメラ・STAP幹細胞作製に成功。(2011.10月頃?)-マイクロナイフで切り、塊で入れて初めて成功。
この後に第三者が捏造するという説なのです。
⑤STAP細胞の成功に嫉妬した犯人が、この後、STAP論文を潰す行動に出る。
成功に嫉妬するというからには成功を知っている人ですからまずはラボメンバーです。小さいラボです。常勤メンバーは若山さんと小保方さんは成功に嫉妬する第三者ではあり得ませんから、奥さん、野老さん、李さん、学生の京極さん、学生の糸井さん、女子学生の寺下さん、テクニカルスタッフの坂出さん、同じく、山中さん、事務の平内さんだけです。
奥さんが御主人の成功に嫉妬するでしょうかね。事務の平内さんはそうい仕事にはタッチできません。糸井さんは小保方さんにGOFのntESを一皿くれた人です。2012年には大学に戻っています。京極さんは最後まで小保方細胞で自分の論文を書くように若山さんから指導されていた人だと手記にある。FLS-T1,2の作成時に若山さんと一緒に小保方さんから作り方を習った人です。野老さんと寺下さんはレター論文の共著者です。
残るのは李さんとテクニカルスタッフの二人の女性だけですが、坂出さんは大田さんとの共著論文もある位のベテランです。李さんはFLS-T1,2の実験時に日本に居ません。山中さんはずっといましたけどね。
でも、第三者ってそもそもあるのでしょうかね。次に和モガさんはその手口について書いている。
⑥若山B6マウスを岡部B6マウス(Acr/CAG-GFP)にすり替え。
成功に嫉妬したために若山B6マウス(CAG-GFP)を岡部B6マウス(Acr/CAG-GFP)にすり替えたというが、若山さんは自分の記者会見でGOFマウスはテクニカルスタッフに任せることもあるが、他のマウスは自分が管理していると答えていて、交配も自分で行うと証言している。和モガさんの説ではこれは第三者を庇う嘘だということになる。若山さんにとってこういう悪事をする人を庇わなければならないとしたら奥さんしかないでしょう。他は単なるいわば使用人です。首にすれば済む話だ。でも、では奥さんがどうしてご主人の関与して成功している実験結果に嫉妬するのでしょうかね。

⑥若山B6マウスを岡部B6マウス(Acr/CAG-GFP)にすり替え。
の後に
⑥若山B6マウスを岡部B6マウス(Acr/CAG-GFP)にすり替え。129xB6GFP 4Nキメラ写真(9.5日胚) (letter 論文 Ex Data Fig 1)
が出来たと。こうやって見てくると和モガさん最初の記述より修正してきているね。でもちゃんと論理が整合していればいい。
ただ、これでも実験を妨害するためにB6を入れ替えたとする推測には4つの難点が残っている。
1.これで妨害したことになってるか。つまり、これが発覚したのは3年後であるが。
2.F1は若山さんしか管理できないと若山さん自身が言ってる。
3.庇われている筈の奥さんには動機がない。成功は生計を一にしている者にとっては喜ばしい。
4.李さんと山中さんがつるんでいたとして、2011/11/28の実験、翌年のFLS、FLB、GLS、胎盤が光ったときの2012年春のキメラ、そしてAC129、更にFLS-T1,2の全てに若山さんの目を逃れて偽マウス、或は「僕のマウス」ESを渡せるか。
続けてフローチャートを下って行こう。
⑦キメラ胚からAcr/CAG-GFPのSTAP幹細胞も作られる。(Chr3/8欠失あり)
⑧2011312.27 GOFマウス(Oct4-GFP)のSTAP細胞をヌードマウスに移植して渡米 小保方氏が渡米中に⑦のSTAP幹細胞をその上に移植。STAP幹細胞はソートしておらずホスト胚のES細胞も混在していた。ES細胞はGFPを持たないのでホストマウス由来細胞だとされた。
⑦は⑥と同時に作られていて増殖確認をするだけだから3継代もすると一応増殖しているという判断はできる。正式な確認は後でちゃんとやればいい。後に小保方さんの行ったFLS1-8全ラインの40継代がそれである。因みに試料が残されているのに、肝心なFLSの実験を小保方さんが行っていることは桂報告は触れずに、ES細胞のグラフを2011年の春に行ったという小保方さんの嘘だけを追求した。震災避難で腰かけている時にES細胞の増殖確認なんかするわけもなければ、そんな分かり切った実験に若山さんが予算を使わせるわけもないことである。
キメラが出来たことを確認できたときには増殖実験も確認できているので、⑥⑦は同時である。
(Chr3/8欠失あり)というのはB6の3番と129の8番にある欠失のことであるが、言うまでもなく、この幹細胞は残されていないのであるから、⑦に書き込むのは誤解を生むかもしれない。ただ⑧のテラトーマからは(Chr3/8欠失あり)が検証されているから、犯人が小保方さんのテラトーマの上から⑦の幹細胞を注射したのなら、⑦の幹細胞には(Chr3/8欠失あり)だったのだろうという演繹推論である。他にテラトーマに入れられた(Chr3/8欠失あり)の細胞があるならば、この時の幹細胞が(Chr3/8欠失あり)だったかどうかは分からないことになる。その証拠に桂報告書は大田ESを小保方さんが注射したと言ってる。どちらが正しいのか。
小保方さんは学生のGOF-ESを持っているので捏造するにしても太田ESを注射するなんて馬鹿げ過ぎている。桂チームと言うのはアルツハイマー集団だと思われる。
まあ、従って、私もここは最初の幹細胞が注射されたと思っているが、私は若山さんが注射した、和モガさんは第三者が注射したと主張しているのである。若山さんの作った筈のこの最初の大事な幹細胞を誰が失敬してテラトーマの各箇所に注射できるのか。私には若山さん本人しか思いつけない。
ここで幹細胞の作り方に関して和モガさんはキメラ胚を使ったと考えて居る。ナイフ切り分けでたくさんの胚盤胞移植が行われ、そのうちの一部は仮親の子宮に挿入されてキメラとなったが、余ったSTAP塊移植後の胚盤胞はしばらく培養された後インナーセルマスを取り出されて、ES培地で培養されたと考えて居る。
インナーセルマスはリシピエントのそもそも持っているインナーセルマスと移植されたSTAP細胞が混在している。所謂共培養状態になっている。
これを取り出してGFPでFACS選別したのが完成されたSTAP幹細胞だという説である。これはクムリナ書き込みから推測されている。
私はクムリナ書き込みはカモフラージュだとしか思ってない。彼は小保方核使用ntESをつくって、その成否をキメラ胚に入れて確認しただけである。キメラが出来ればその株はntES化に成功しているということになる。ntESは培養できただけでは駄目でキメラ樹立まで確認されないといけない。ここは私もなぜキメラ胚に一度入れるのかが分かってなかった時期がある。なんだか自然に分かってきた。
さてここまででキメラと幹細胞はできた。和モガ説であると最初のキメラは若山さんがナイフ切り分けで作ったのである。そしてこの時の幹細胞も若山さんが小保方さんに出来たといったのだからどういう作り方はともかくとしてできた。本当の成功である。
その後に、第三者が若山B6を岡部B6に取り換えた。(F1を交配したのは若山さんで、GOF以外はテクニカルスタッフに任せてないと記者会見で答えているのだが、第三者は奥さんということなのであろうか。奥さんが旦那の成功を妬んだと?)
ということは最初の成功マウスは若B6-CAGだったという推定であるが、誰かがそんなことを言ったであろうか。若山さんはFLSに関して「僕のマウス」を渡したと証言しただけで、前年度の最初の実験でどんなマウスを使ったか語ってない。ただ、2011/11/28撮影の4Nキメラに関して129/Sv x B6GFPだと答えただけである。
僕のマウスというのは129-CAG-GFP x B6-CAG-GFPのF1マウスのことである。
第三者は最初の実験で若山さんが129 x B6-CAG-GFPのF1マウスを使って成功したのだと知っていることになる。そして成功を羨んで妨害しようとして次の実験の時に129 x B6-Acr-CAG-GFPのF1マウスを渡したという。妨害者は三年後に理研の調査でアクロシンが発見できるように妨害しようとしたというのか。途中で小保方さんが理研に拾われなかったら、アクロシンマウスは発見されなかったかも知れない。何を妨害したことになるのであろうか。そもそも妨害されなくても三誌リジェクトされている。
フローチャートを下ると以下のように続く。
⑦キメラ胚からAcr/CAG-GFPのSTAP幹細胞も作られる。(Chr3/8欠失あり)
↓
⑦のSTAP幹細胞からクローンマウス(Chr3/8欠失)が作られ、その仔マウスが小保方氏に渡される。
誰がクローンマウスを作ったのか? 第三者がクローンマウスを作って小保方さんに渡したのか。仔マウスは若山さんが交配して後、彼自身が小保方さんに渡すと記者会見で述べられている。
2011/11/28の幹細胞からクローンマウスを作るのに20日かかる。2011/12/18である。その仔を作るには親の成熟を待たねばならない。早くても50日かかる。そこから交配して更に20日後に仔マウスが得られる。
ここに無茶な推定が入っているのだけれども、逆に、なぜ和モガさんはこういうクローンを考えなければならないのかと推測すると、翌年の初頭の実験に関して若山さんが「僕のマウス」を渡したと言ってるから、若山さんは騙されて実は第三者がアクロシン入りマウスに取り換えたとしなければならないからであろう。そもそもが最初から使われているB6はアクロシン入りで、若山さんが嘘をついて「僕のマウス」を渡したのだと言ってるというストーリーでないところから来る無理ではないかな。
私はクローン胚からntES化していると考えて居る。これだと無理がない。犯人は若山さんです。
それを若山さんは無実で最初成功していたのに、第三者が嫉妬して、アクロシンマウスと取り換えたというストーリーに対して、事実関係の情報が不整合になるのだと思われる。そもそもアクロシンマウスに取り換えることが当面の妨害にすらなってないではないかと疑義されるところでもある。アクロシンが問題になったのは3年後ですよ。しかも、あのまま小保方さんが渡米したままだったら何の問題も起きてない。
取り敢えず、Ooboe さんのご依頼に対する回答はこのくらいにしておきましょう。Ts.Marker さんには別途コメント欄に書いて置きましょう。
①桂報告書---キメラと幹細胞の既存ESコンタミ捏造説は完全論破されている。
②第三者妨害説---和モガ説。今批判した。
③キメラは論文通りにできている。幹細胞は論文通りではなく共培養で作られた。---Ts.Marker 説
④キメラも幹細胞も論文通りにできている。---Ooboeさんとパートナー氏説。検察申請中。
⑤キメラと幹細胞は小保方核使用ntES---居士説。
- 2020/01/25(土) 09:23:25|
- ミトコンドリア
-
-
| コメント:9