対訳ティシュー論文
(原文)
TISSUE ENGINEERING: Part A Volume 17, Numbers 5 and 6, 2011 ª Mary Ann Liebert, Inc. DOI: 10.1089/ten.tea.2010.0385
The Potential of Stem Cells in Adult Tissues Representative of the Three Germ Layers
Haruko Obokata, M.S.,1–3 Koji Kojima, M.D., Ph.D.,1 Karen Westerman, Ph.D.,1 Masayuki Yamato, Ph.D.,3 Teruo Okano, Ph.D.,3 Satoshi Tsuneda, Ph.D.,2 and Charles A. Vacanti, M.D.1
1.Laboratory for Tissue Engineering and Regenerative Medicine, Department of Anesthesiology, Harvard Medical School, Brigham and Women’s Hospital, Boston, Massachusetts. 2.Department of Life Science and Medical Bioscience, Waseda University, Tokyo, Japan. 3.Institute of Advanced Biomedical Engineering and Science, Tokyo Women’s Medical University, Tokyo, Japan.
(和訳)
組織エンジニアリング:パートA第17巻、第5号と第6号、ªMary Ann Liebert、Inc. DOI:10.1089 / ten.tea.2010.0385
三胚葉各成体組織内在幹細胞の潜在能力
小保方晴子修士<注1-3>、小島浩司医師・博士<注1>、カレン・ウェスターマン博士<注1>、大和雅之博士<注3>、岡野光夫博士<注3>、常田聡博士<注2> チャールズ・A・ヴァカンティ医師<注1>
1、マサチューセッツ州ボストン、ブリガム・アンド・ウィミンズ病院、ハーバード医科大学麻酔学部、細胞組織工学・再生医学研究室。 2.日本国東京都、早稲田大学、生命科学・医療生物科学部。 3.日本国東京都、東京女子医科大学、先端生物医療工学・科学研究所
(原文)
Abstract
Mature adult tissues contain stem cells that express many genes normally associated with the early stage of embryonic development, when maintained in appropriate environments. Cells procured from adult tissues representative of the three germ layers (spinal cord, muscle, and lung), each exhibiting the potential to mature into cells representative of all three germ layers. Cells isolated from adult tissues of different germ layer origin were propagated as nonadherent clusters or spheres that were composed of heterogeneous populations of cells. When the clusters or spheres were dissociated, the cells had the ability to reform new, nonadherent spheres for several generations. When implanted in vivo, in association with biodegradable scaffolds, into immunodeficient mice, tissue containing cells characteristic of the three germ layers was generated. These findings suggest the existence of a population of stem cells in adult tissues that is quite different and distinct from embryonic stem cells that demonstrate a greater potency for differentiation across germ lines than previously believed. Such cells could potentially be as useful as embryonic stem cells in tissue engineering and regenerative medicine.
(和訳)
概要
成熟した成体組織は、適切な環境下で維持される場合、胚発生の初期段階に通常関連する多くの遺伝子を発現する幹細胞を含む。 三胚葉を代表する成体組織(脊髄、筋肉、および肺)から調達された細胞は、それぞれ三胚葉すべてを代表する細胞に成熟する可能性を示す[訳注:動詞不在文に付き意訳]。異なる胚葉起源の成体組織から単離された細胞は、細胞の異種集団からなる非接着性クラスターまたは球状体として増殖した。クラスターまたは球状体が解離したとき、細胞は数世代にわたり新しい非接着性球状体を改変する能力を有していた。インビボで、生分解性足場に関連して免疫不全マウスに移植された場合、三胚葉に特徴的な細胞を含む組織が生成された。これらの知見は胚性幹細胞とは全く異なる、成体組織内幹細胞集団の存在を示唆している。それは以前に信じられていたよりもより大きな、世代を跨いでの分化能力を示している。そのような細胞は将来的に組織工学および再生医療において胚性幹細胞と同様に有用であり得る。
(原文)
Introduction
The degree of potency of adult stem cells as compared to embryonic stem cells (ESCs) remains controversial. It is generally felt that while ESCs and induced pluripotent stem cells[1] demonstrate pluripotency, adult stems cells are limited to multipotency and are felt not to be able to cross the germ layer lineages as they develop. Although the existence of adult stem cells has been reported[2–5] for more than a decade, we have hypothesized the existence of adult stem cells, which are quite small and resistant to external stress, that reside in tissues representative of the three germ layers.[2] Adult stem cells have generally been felt to be limited to multipotency and unable to cross germ layer lineages as they develop. Cells derived from many adult tissues, including retina,[6] brain,[7–10] cornea,[11] olfactory neuroepithelium,[12,13] pancreas,[14] skin,[15,16] muscle,[17] and bone marrow (BM),[18,19] have now been propagated as nonadherent clusters or spheres,as have ESCs.[20] The cells contained within the spheres exhibit neural lineage markers and appear to possess varying degrees of stem cell potency. In addition, neurospheres have been shown to contain stem cells demonstrating gene express
that overlap that of ESCs.
(和訳)
導入
胚性幹細胞(ES細胞)と比較した成体幹細胞の能力の程度には議論の余地がある。 ES細胞および誘導された多能性幹細胞[1]は多能性を示すが、成体幹細胞は多分化能に制約されており、胚芽層系統が発達するにつれて胚葉を横断できないと思われている。成体幹細胞の存在は10年以上にわたって報告[2–5 ]されているが、私たちは三胚葉を代表する組織に存在する、非常に小さく、外部ストレスに強い成体幹細胞の存在を仮説とした。[2] 成体幹細胞は、一般に、多分化能に制約されていて、発達すると胚葉系統を横断できないと思われている。網膜[6]、脳[7-10]、角膜[11]、嗅覚神経上皮[12,13]、膵臓[14]、皮膚[15,16]、筋肉[17]、および骨髄(BM)[18,19] を含む多くの成人組織に由来する細胞は、ES細胞がそうであるように、非粘着性クラスターやスフィアとして現在知られている。[20] スフィア内に含まれる細胞は神経系統マーカーを示していて、様々な程度の幹細胞能力を有するようにみえる。加えて、ニューロスフェアはES細胞のそれと重複する遺伝子発現を示す幹細胞を含むことが示されてきている。
(原文)
We believe that adult stem cells described in various reports represent the same adult stem cells at different stages of development, expressing different degrees of potency and that sphere-forming cells are much more immature than previously expected. We hypothesized that adult stem cells procured from any tissue, ectoderm, mesoderm, or endoderm cross germ layers as they develop, when maintained in appropriate environments in vitro and in vivo. In this study, we characterized cells isolated from three adult tissues (spinal cord, muscle, and lung) representative of the three different germ layers (ectoderm, mesoderm, and endoderm) and from BM.
(和訳)
我々は、様々な報告書に記載されている成体幹細胞は、程度の異なる能力を発現している、異なる発達段階の同一の成体幹細胞であると、また、球状体細胞は予期されたよりも未成熟であると信じている。成体内であれ試験管内であれ適切な環境下で維持された場合、外胚葉、中胚葉、または内胚葉のいずれの組織から得られた成体幹細胞も分化の際に胚葉を横断すると仮定した。この研究では、3つの異なる胚葉(外胚葉、中胚葉および内胚葉)を代表する3つの成体組織(脊髄、筋肉、および肺)からと、BMから単離された細胞を調査した。
(原文)
Mature cells were disrupted by trituration and then propagated as nonadherent clusters or spheres in a serum-free culture medium. Cells procured from each source initially expressed many of the markers associated with ESCs and demonstrated the potential to differentiate into all three germ layers, in vitro and in vivo. The isolation initially contained a significant amount of floating debris, nonadherent cells, insoluble proteins or fibers, and other extraneous materials, all of which appeared to participate in the formation of nonadherent spherical clusters that contained the cells. The cellular make-up of individual spheres was not identical; that is, spheres were composed of heterogeneous populations of cells, even when the spheres were generated from cells procured from the same tissue at the same time. Similarities or differences seen in the cell content of different spheres were believed to be secondary to the environment in which they were cultured.
(和訳)
成体細胞を粉砕により破壊し、次いで無血清のクラスターまたはスフィアとして無血清培地中で増殖させた。各供給源から調達した細胞は、ES細胞に関連する多くのマーカーを最初に発現し、試験管内でも生体内でも三胚葉すべてに分化する能力を示した。この分離物は最初かなりの量の浮遊破片、非接着細胞、不溶性タンパク質または繊維、およびその他の外来物質を含んでいた。そしてそれら全てがこの細胞を含む非接着性球状クラスターの形成に関与しているように見える。個々のスフィアの細胞構成は同一ではなかった。すなわち、スフィアは、それらが同じ組織から同時に調達された細胞から作られていても、細胞の異種集団で構成されていた。異なるスフィアに含まれる細胞に見られる類似点または相違点は、それらが培養された環境に関係していると思われた。
(原文)
Materials and Methods
Cell isolation and cell culture
BM, spinal cord (ectoderm), muscle (mesoderm), and lung (endoderm)were collected from 3-to4-week-old and 12-week-old C57BL/6J mice (Jackson Laboratory). C57BL/6J (B6) mice were anesthetized with Avertin(2,2,2-tribromoethanol)(SigmaAldrich). All tissues were obtained according to the guidelines from Harvard University IACUC. Mouse femurs and tibias were aseptically dissected and cut. The BM was extruded by flushing with culture media using an insulin syringe. The cell suspension obtained was centrifuged at 2000rpm for 5min and washed with F12/Dulbecco’s modified Eagle’s medium (DMEM; 1:1, v/v; Gibco). The cell suspension was passed through 100µm nylon filters (BD Falcon) and centrifuged at 2000rpm for 5min, washed once more, and centrifuged at 2000rpm for 5min. To remove the erythrocytes, the cell suspension was treated with RBC Lysis Buffer (eBiosciencel). Cells were triturated vigorously and passed through 70 and 40µm nylon filters. Spinal cord tissue was dissected and thoroughly minced. Cells were triturated vigorously and passed through 100, 70, and 40µm nylon filters.
(和訳)
材料および方法
細胞単離および細胞培養
3週齢〜4週齢および12週齢のC57BL / 6Jマウス(Jackson Laboratory)からBM、脊髄(外胚葉)、筋肉(中胚葉)および肺(内胚葉)を採取した。C57BL / 6J(B6)マウスを、アベルチン(2,2,2-トリブロモエタノール)(SigmaAldrich)で麻酔した。すべての組織は、ハーバード大学IACUCのガイドラインに従って採取された。マウスの大腿骨および脛骨を無菌的に切開、切断した。 骨髄をインスリンシリンジを用いた培養液で洗浄することによって洗い出した。得られた細胞懸濁液を2000rpmで5分間遠心分離し、F12 /ダルベッコ改変イーグル培地(DMEM; 1:1、v / v; Gibco)で洗浄した。細胞懸濁液を100µmナイロンフィルター(BD Falcon)で濾過し、2000rpmで5分間遠心分離し、もう一度洗浄し、2000rpmで5分間遠心分離した。赤血球を除去するために、細胞懸濁液をRBC溶解緩衝液(eBiosciencel)で処理した。細胞を激しく粉砕し、70および40µmのナイロンフィルターに通した。脊髄組織を切開し、完全に細かく刻んだ。細胞を激しく粉砕し、100,70および40µmのナイロンフィルターで濾過した。
(原文)
The cell suspension was collected and centrifuged at 2000rpm for 5min. Muscle from the thigh was excised and thoroughly minced. The tissue was treated with 0.2% collagenase D (Roche) for 1h at 37℃. Cells were triturated vigorously and passed through 100, 70, and 40µm nylon filters. Cell suspensions were collected and centrifuged at 2000rpm for 5min. Lung tissues were washed via intratracheal lumen with 10mL of cold phosphate buffered saline (PBS; Gibco) and were perfused with collagenase type P (Roche). Percoil gradient centrifugation was employed to remove contaminating erythrocytes, neutrophils, and cell debris. Cells were triturated vigorously and passed through 100, 70, and 40µm nylon filters. Cell suspensions were collected and centrifuged at 2000rpm for 5min.
(和訳)
細胞懸濁液を回収し、2000rpmで5分間遠心分離した。 太ももからの筋肉を摘出し、完全に細かく刻んだ。 組織を0.2%コラゲナーゼD(Roche)で37℃で1時間処理した。 細胞を激しく粉砕し、100,70および40µmのナイロンフィルターで濾過した。細胞懸濁液を回収し、2000rpmで5分間遠心分離した。 肺組織を、10mLの冷リン酸緩衝食塩水(PBS; Gibco)で気管内内腔を通して洗浄し、コラゲナーゼタイプP(Roche)で灌流した。 パーコイル勾配遠心分離を用いて、混入する赤血球、好中球および細胞破片を除去した。 細胞を激しく粉砕し、100,70および40µmのナイロンフィルターで濾過した。細胞懸濁液を回収し、2000rpmで5分間遠心分離した。
(原文)
Cells from each tissue type were plated at 1x10 cells/㎠ in F12/DMEM (1:1, v/v) supplemented with 2% B27 (Invitrogen), 20ng/mL basic fibroblast growth factor (bFGF; R&D Systems), and 10ng/mL epidermal growth factor (EGF; R&D Systems). About 50% of the medium was replaced every 2–3 days for the duration of the culture; bFGF and EGF were added every other day. To calculate the doubling time of cells, the number of cells was counted daily as cells proliferated to form spheres. As the spheres grew in size, representative spheres were dissociated and the cell number were counted, doubling times were calculated.
(和訳)
各組織型からの細胞を、2%B27(Invitrogen)、20ng / mLの塩基性線維芽細胞成長因子(bFGF; R&D Systems) および10ng / mL表皮成長因子(EGF; R&D Systems)を補充したF12 / DMEM(1:1、v / v)の中に、平方センチ当たり1x10の6乗個蒔種した。 培地の約50%が培養期間中2〜3日ごとに交換された。 bFGFおよびEGFを1日おきに添加した。 細胞の倍増時間を計算するために、細胞が増殖して球体を形成するに従って細胞数を毎日計数した。 球体のサイズが大きくなるにつれて、代表的なスフィアを解離し、細胞数を数え、倍増時間を計算した。
(原文)
Cell size measurement
Marrowspheres from 4-week-old mice, collected after 5 days in the fresh medium, were dissociated into single cells. Dissociated cells were stained with propidium iodide filtered through a 40µm pore filter and measured on a DAKO Galaxy (DAKO) using FloMax software. Cytofluorimetric analysis was then performed to establish cell size. Microbeads of predefined sizes (Size Calibration Standards Kit; Bangs Laboratories, Inc.) were re-suspended in isotonic phosphate saline (pH 7.2) and used as a standard for which to compare size of cells contained in spheres using cytofluorimetric analysis.
Both cells and beads were analyzed using the same instrument setting (forward scatter, representing cell and bead size, and side scatter, representing cellular granularity). Cell size was calculated on a curve employing bead size on the x-axis and forward scatter values on the axis.
(和訳)
セルサイズ測定
新鮮な培地で5日後に収集した4週齢マウスからの骨髄スフィアを単細胞に解離させた。 解離した細胞を40µm孔フィルターで濾過したヨウ化プロピジウムで染色し、FloMaxソフトウェアを使用したDAKO Galaxy(DAKO)で測定した。 その後、細胞サイズを確立するために細胞質分析を行った。 所定の大きさのマイクロビーズ(サイズキャリブレーションスタンダードキット; Bangs Laboratories、Inc。)を等張性リン酸塩生理食塩水(pH 7.2)に再懸濁し、細胞浮遊分析を用いて球に含まれる細胞の大きさを比較するための標準として使用した。
細胞およびビーズの両方を、同じ機器設定(前方散乱、細胞およびビーズサイズ、および側方散乱、細胞細分性を表す)を用いて分析した。 細胞サイズは、x軸上のビーズサイズおよび軸上の前方散乱値を用いた曲線上で計算した。
(原文)
Immunohistochemistry
The protein expression of spheres was assessed using immunohistochemical techniques. Spheres were collected using the cell strainer and rinsed with PBS twice. Then, spheres with the membrane were embedded and sliced at 4mm thickness. Each slide was fixed with 4% paraformaldehyde (Wako) for 15min at room temperature, washed with PBS, incubated with SuperBlock-R blocking buffer in PBS (P74370; Takara) for 30min to block nonspecific reactions, and incubated with anti-c-kit rat monoclonal antibody (sc-19619; Santa Cruz Biotechnology, Inc), anti-Sca-1 rat monoclonal antibody (ab25031; Abcam), or anti-E-cadherin rat monoclonal antibody (ab11512; Abcam) overnight at 48C. After washing with PBS, the cells were incubated with goat anti-rat IgG Texas Red-conjugated antibodies (112-076-062; Jackson ImmunoResearch) and goat anti-rat IgG Fluoresceinconjugated antibodies (112-096-062; Jackson ImmunoResearch) for 30min at room temperature. Stage-specific embryonic antigen-1 and alkaline phosphatase staining was performed using the ES cell detection Kit (Millipore) in accordance with the manufacturer’s protocol. In negative controls, the primary antibody was replaced with IgGnegative controls of the same isotype to ensure specificity.
(和訳)
免疫組織化学
免疫組織化学的手法を用いてスフィアのタンパク質発現を評価した。細胞ストレーナーを用いてスフィアを回収し、PBS<訳注;リン酸緩衝生理食塩水,Phosphate buffered saline, 略称: PBS>で2度すすいだ。次に、膜を有するスフィアを埋め込み、4mmの厚さにスライスした。各スライドを室温で15分間4%パラホルムアルデヒド(Wako)で固定し、PBSで洗浄し、非特異的反応をブロックするためにSuperBlock-Rブロッキング緩衝液を使ってPBS(P74370; Takara)の中で30分間インキュベートし、抗c-kitラットモノクローナル抗体(sc-19619; Santa Cruz Biotechnology、Inc)、抗Sca-1ラットモノクローナル抗体(ab25031; Abcam)または抗E-カドヘリンラットモノクローナル抗体(ab11512; Abcam)で48℃で一晩インキュベートした。 PBSで洗浄した後、ヤギ抗ラットIgGテキサスレッドコンジュゲート抗体(112-076-062; Jackson ImmunoResearch)およびヤギ抗ラットIgGフルオレセインコンジュゲート抗体(112-096-062; Jackson ImmunoResearch)と共に30分間室温でインキュベートした。 ES細胞検出キット(Millipore)を使用して、製造業者のプロトコールに従って、段階特異的胚性抗原-1およびアルカリ性ホスファターゼ染色を行った。ネガティブコントロールとして、一次抗体を同じアイソタイプのIgGネガティブコントロールで置換して特異性を確保した。
(原文)
In vitro differentiation assay
Mesoderm lineage differentiation assay. The spheres were collected at 5 days and dissociated into single cells, and placed in DMEM supplemented 20%fetal calf serum(FCS).The medium was exchanged every 3 days. After 7–14 days, muscle cells were stained with anti-a-smooth muscle actin antibody (N1584; DAKO), anti-myosin antibody (ALX-805-503), and anti-desmin antibody (D1033; Sigma). In negative controls, the primary antibody was replaced with IgG-negative controls of the same isotype to ensure specificity. Chondrocytes were stained with Safranin-O (Fisher; S67025) and Fast Green (Fisher; F99). Osteocytes were stained with Alizarin Red S (Sigma; A5533). After 21 days, adipocytes were stained with Oil Red O (Sigma; O-0625).
(和訳)
試験管内分化試験
中胚葉系譜分化実験。 スフィアを5日目に収集し、単一細胞に解離させ、20%ウシ胎児血清(FCS)を補充したDMEM <訳注:Dulbecco's Modified Eagle Medium>に入れた。培地を3日ごとに交換した。 7-14日後、筋細胞を抗α-平滑筋アクチン抗体(N1584; DAKO)、抗ミオシン抗体(ALX-805-503)および抗デスミン抗体(D1033; Sigma)で染色した。 ネガティブコントロールとして、一次抗体を同じアイソタイプのIgG陰性対照と交換して特異性を確保した。 軟骨細胞は、Safranin-O(Fisher; S67025)およびFast Green(Fisher; F99)で染色された。 骨細胞をAlizarin Red S(Sigma; A5533)で染色した。 21日後、脂肪細胞をオイルレッドO(Sigma; O-0625)で染色した。
(原文)
Neural lineage differentiation assay. The spheres were collected at 5 days and dissociated into single cells, which were plated on ortinin-coated chamber slides (Nalge Nunc International) in F12/DMEM (1:1, v/v) supplemented 2% B27 (Invitrogen), 10% FCS, 10ng/mL bFGF (R&D Systems), and 20ng/m EGF (R&D Systems). The medium was exchanged every 3 days. After 10–14 days, cells were fixed with 4% paraformaldehyde for 30min at 48C, washed with PBS containing 0.2% Triton X-100 (Sigma) for 15min at room temperature, incubated with PBS containing 2% FCS for 20min to block nonspecific reactions, and incubated with anti-bIII Tubuin mouse monoclonal antibody (G7121; Promega), anti-O4 mouse monoclonal antibody (MAB345; Millipore), and anti-glial fibrillary acidic protein (GFAP) mouse monoclonal antibody (AB5804; Chemicon). In negative controls, the primary antibody was replaced with IgG-negative controls of the same isotype to ensure specificity.
(和訳)
神経系統分化実験。 スフィアを5日目に収集し、単一細胞に解離させ、2%B27(Invitrogen)、10% FCS<訳注:Fetal calf serum ウシ胎仔血清>、10ng / mL bFGF(R&D Systems)、および20ng / m EGF(R&D Systems)を補充したF12 / DMEM(1:1、v / v)中のオルチニン被覆チャンバースライド(Nalge Nunc International)上に置いた。 培地は3日ごとに交換した。 10-14日後、細胞を4%パラホルムアルデヒドで48℃で30分間固定し、0.2%Triton X-100(Sigma)を含有するPBSで室温で15分間洗浄し、非特異的反応 を防ぐために2%FCS含有PBSで20分間インキュベートし(G7121; Promega)、抗O4マウスモノクローナル抗体(MAB345; Millipore)、および抗グリア毛酸性タンパク質(GFAP)マウスモノクローナル抗体(AB5804; Chemicon)と共にインキュベートした。 ネガティブコントロールとして、一次抗体を同じアイソタイプのIgG陰性対照と交換して特異性を確保した。
(原文)
Hepatic differentiation assay. The spheres were collected at day 5 and dissociated into single cells, which were plated on chamber two-well slide glass (Nalge Nunc International) in the hepatocyte culture medium composed of 500mL hepatocyte basal medium (Lonza), 0.5mL ascorbic acid, 10mL bovine serum albumin-fatty acid free, 0.5mL hydrocortisone, 0.5mL transferrin, 0.5mL insulin, 0.5mL EGF, and 0.5mL gentamycin-amphotericin (GA-1000; all from Lonza) supplemented with 10% FCS and 1% penicillin/streptomycin (Sigma). Differentiated cells were detected by immunohistochemistry using following antibodies: anti-a-fetoprotein (AFP) mouse monoclonal antibody (MAB1368; R&D System), anti-Albumin goat polyclonal antibody (sc-46293; Santa Cruz Biotechnology, Inc.), and anti-Cytokeratin 18 (CK18) mouse monoclonal antibody (ab668; Abcam). In negative controls, the primary antibody was replaced with IgGnegative controls of the same isotype to ensure specificity. The results from immunohistochemistry were confirmed by reverse transcription (RT)-polymerase chain reaction (PCR). The presence of microtubule-associated protein 2 (Map2) was evaluated for neural lineage, MyoD was evaluated for mesoderm lineage, and AFP was done for hepatic differentiation.
(和訳)
肝分化実験。スフィアを5日目に収集し、単一細胞に解離させ、これを10%FCSおよび1%ペニシリン/ストレプトマイシン(Sigma)を補充した、500mLの肝細胞基礎培地(Lonza)、0.5mLのアスコルビン酸、10mLの脂肪酸不含ウシ血清アルブミン 、0.5mLのヒドロコルチゾン、0.5mLのトランスフェリン、0.5mLのインスリン、0.5mLのEGF、 および0.5mLのゲンタマイシン - アンホテリシン(GA-1000;すべてLonza製)からなる幹細胞培地中のチャンバー2ウェルスライドガラス(Nalge Nunc International)上に置いた。分化した細胞は、以下の抗体を用いて免疫組織化学によって検出した:抗α-フェトプロテイン(AFP)、マウスモノクローナル抗体(MAB1368; R&D System)、抗アルブミンヤギポリクローナル抗体(sc-46293; Santa Cruz Biotechnology、Inc。)、および抗-A-フェトプロテインサイトケラチン18(CK18)マウスモノクローナル抗体(ab668; Abcam)。 ネガティブコントロールとして、一次抗体を同じアイソタイプのIgG陰性対照と交換して特異性を確保した。 免疫組織化学の結果は逆転写(RT) - ポリメラーゼ連鎖反応(PCR)によって確認した。微小管関連タンパク質2(Map2)の存在を神経系統として評価し、MyoDを中胚葉系統として評価し、AFP<訳注:α-fetoprotein>を肝臓分化として評価した。
(原文)
Single sphere RT-PCR
Single spheres were individually collected at day 5 under a phase-contrast microscope. Total RNA was extracted using the RNeasy Micro Kit (Qiagen) in accordance with the manufacturer’s protocol. To eliminate the risk of false-positives, RNA was isolated fromES cells andE 6.5 fetalcells as positive controls, and RNA was also isolated from heart, muscle, liver, and adherent stromal cells as negative controls for embryonic gene marker expression in RT-PCR. RNA was treated with DnaseI before RT to remove any genomic DNA. Minus-RT controls were run for each cDNA preparation to rule out genomic contamination. Total RNA (10.0ng) was then subjected to oligo-dT-primed RT with SuperScriptIII First-Strand Synthesis SuperMix (Invitrogen). RT-PCR was performed using TaqDNA polymerase (Takara) on an iCycler (BioRad). After an initial incubation at 94℃ for 3min, PCR was carried out at 94℃, for 30s, at specific annealing temperature for 30s and at 72℃ for 30s with a final extension cycle at 72℃ for 1min. A total of 35 cycles were performed. PCR products were electrophoresed on 2% agarose TBE gels. Gene-specific primers for RT-PCR were designed based on published sequences (Supplementary Table S1; Supplementary Data are available online at www.liebertonline.com/ten).
(和訳)
単一スフィアRT-PCR
単一スフィアを、5日目に位相差顕微鏡下で個別に収集した。 RNeasy Micro Kit(Qiagen)を用いて製造者のプロトコールに従って全RNAを抽出した。偽陽性の危険性を排除するために、陽性対照としてRNAをES細胞および6.5胎児細胞から単離し、陰性対照としてRNAを心臓、筋肉、肝臓および付着間質細胞からも単離し、RT-PCRにおける胚性遺伝子マーカー発現をみた。 RNAをRT前にDnaseI<訳注:Deoxyribonuclease I>で処理してゲノムDNAを除去した。ゲノムの混入を排除するために、各cDNA調製物についてマイナス-RT対照を行った。次いで、全RNA(10.0ng)を、SuperScriptIII First-Strand Synthesis SuperMix(Invitrogen)を用いてオリゴdTプライムRTに供した。 iCycler(BioRad)上のTaqDNAポリメラーゼ(Takara)を用いてRT-PCRを行った。 94℃で3分間の最初のインキュベーションの後、94℃で30秒間、特異的アニーリング温度で30秒間および72℃で30秒間の後、最終伸長サイクルで72℃で1分間PCRを実施した。合計35サイクルを行った。 PCR産物を2%アガロースTBEゲルで電気泳動した。 RT-PCRのための遺伝子特異的プライマーは、公表された配列に基づいて設計された(補足表S1;補足データは、www.liebertonline.com/tenからオンラインで入手可能である)。
(原文)
In vivo differentiation assay
Sphere cultures from representative tissues were washed twice with Hank’s balanced salt solution (Gibco). Under a microscope, 2000 spheres, each containing *1000 cells, were collected using a glass pipette and placed in a 50mL tube. Hank’s balanced salt solution (20mL) was added to each tube and subsequently centrifuged at 800rpm for 3min. The supernatant was discarded and the pellet was resuspended in 50mL of DMEM with 10% fetal bovine serum. This solution was seeded onto a sheet 3x3x1mm, composed of a nonwoven mesh of polyglycolic acid fibers, 200µm in diameter, and implanted subcutaneously into the dorsal flanks of a 4-week-old NOD/SCID mice (Jackson Laboratory).
(和訳)
生体内分化実験
代表的な組織からの球状体をハンクス平衡塩類溶液(Gibco)で2回洗浄した。 顕微鏡下で、それぞれ1000個の細胞を含んだ2000個の球状体をガラスピペットを用いて収集し、50mLチューブに入れた。 ハンクの平衡塩類溶液(20mL)を各試験管に添加し、続いて800rpmで3分間遠心分離した。 上清を捨て、ペレットを10%ウシ胎仔血清を含む50mLのDMEMに再懸濁した。 この溶液を、直径200µmのポリグリコール酸繊維の不織メッシュからなる3x3x1mmのシート上に播種し、4週齢のNOD / SCIDマウス(Jackson Laboratory)の背部皮下に移植した。
(原文)
Four weeks later the implants were harvested, and analyzed using immunohistochemical techniques. The implants were fixed with 10% formaldehyde, embedded in paraffin, and routinely processed into 4µm thickness. Sections were stained with hematoxylin and eosin. Cartilage was confirmed using Safranin-O (Fisher; S670-25). Duct and gland-like tissues were identified using the endoderm marker, rabbit polyclonal FOXA2 (Abcam; ab40874). Epithelium-like structures were identified using mouse monoclonal [PCK-26] Pan cytokeratin antibody (Abcam; ab6401). Muscle-like structures were identified using mouse monoclonal desmin antibody (Sigma; D1033) and anti-a-smooth muscle actin antibody (N1584; Dako). Nerve-like structures were identified using mouse monoclonal beta III tubulin antibody (Promega; G7121). In negative controls, the primary antibody was replaced with IgG-negative controls of the same isotype to ensure specificity. All sections were then peroxidase stained using the LSAB 2 kit (DakoCytomation) according to the manufacturer’s protocol. The experiments were reviewed and approved by Harvard Medical Area Standing Committee in Animals.
(和訳)
4週間後、インプラントを採取し、免疫組織化学的手法を用いて分析した。移植細胞を10%ホルムアルデヒドで固定し、パラフィンに包埋し、手順通り4µmの厚さに加工した。切片をヘマトキシリンおよびエオシンで染色した。軟骨は、Safranin-O(Fisher; S670-25)を用いて確認した。樹状細胞および腺様組織は、内胚葉マーカーであるウサギポリクローナルFOXA2(Abcam; ab40874)を用いて同定した。上皮様構造は、マウスモノクローナル[PCK-26]汎サイトケラチン抗体(Abcam; ab6401)を用いて同定した。筋様構造は、マウスモノクローナルデスミン抗体(Sigma; D1033)および抗A平滑筋アクチン抗体(N1584; Dako)を用いて同定した。神経様構造は、マウスモノクローナルベータIIIチューブリン抗体(Promega; G7121)を用いて同定した。ネガティブコントロールとして、一次抗体を同じアイソタイプのIgG陰性対照と交換して特異性を確保した。次いで、全ての切片を、LSAB 2キット(DakoCytomation)を用いて製造業者のプロトコールに従ってペルオキシダーゼ染色した。実験はHarvard Medical Area Standing Committee in Animalsによって審査され承認された。
(原文)
Results
Sphere formation
Regardless of the tissue from which they had been isolated, cells triturated through reduced glass pipettes and grown in vitro formed nonadherent spheres. Spheres of up to 150mm in diameter, generated from marrow-derived cells, arose within 5 days (Fig. 1A). Cells from other adult tissue representative of the three germ layers, spinal cord (ectoderm), muscle (mesoderm), and lung (endoderm), formed spinal spheres, myospheres, and pneumospheres, respectively, within 5 days of isolation (Fig. 1B–D). Individual spheres possessed >2000 cells. The doubling time of cells within the spheres of ~12±4h represented the average doubling time of mixed populations of cells within individual spheres.To assess the self-renewing potential of sphere-forming cells, spheres were dissociated into single cells and replated, resulting in the generation of secondary spheres (Fig. 1E, F, example marrowderived spheres). Disassociated cells were capable of forming spheres for at least five generations in this experiment.
(和訳)
結果
スフィア形成
それらが単離された組織とは無関係に、先を細めたガラスピペットで粉砕され、試験管内で増殖した細胞は非接着スフィアを形成する。骨髄由来細胞から生成された直径150mmまでのスフィアが5日以内に生じた(図1A)。単離5日以内に、脊髄(外胚葉)、筋肉(中胚葉)および肺(内胚葉)の三胚葉を代表する他の成体組織由来細胞が、それぞれ脊椎スフィア、筋スフィアおよび肺炎球スフィアを形成した(図1B- D)。個々のスフィアは 2000個以上の細胞を有していた。12時間±4時間内のスフィア内細胞の倍加時間は、個々のスフィア内の混合集団細胞の平均倍加時間を意味した。スフィア形成細胞の自己再生能を評価するために、スフィアを単一細胞に解離させて培養した結果、二次スフィアの生成を見た(図1E、F、骨髄スフィアの例)。 解離した細胞は、この実験において少なくとも5世代にわたってスフィアを形成することができた。
(原文)
Immature cell marker expression
Expression of immature markers, which are widely recognized as stem cell markers using immunohistochemistry, was then assessed. Representative spheres from each tissue contained cells positive for stage-specific embryonic antigen1 (Fig. 1G), and expressed alkaline phosphatase activity (10% of the spheres) (Fig. 1H), c-kit (Fig. 1I), Sca-1 (Fig. 1J), and E-cadherin (Fig. 1K, example marrow-derived spheres). Expression of every surface marker was not identified in every sphere. Spheres generated from the same tissues were not identical and appeared to contain a heterogeneous population of primitive cells. The number of spheres formed was 116±5(n=5) per 10 million cells initially plated. When cells were procured from mice >12 weeks of age, the average number of spheres generated was less (Supplementary Fig. S1). Early in the formation of spheres, the contained cells were quite small in size, as demonstrated by the flow cytometry analysis, with the majority (~60%–70% in all cases) being <8µm in diameter.
(和訳)
未成熟細胞マーカー発現
次いで、免疫組織化学を用いて幹細胞マーカーとして広く認識されている未成熟マーカーの発現を評価した。各組織の代表的なスフィアは、段階特異的胚性抗原1(図1G)を含み、アルカリホスファターゼ活性(スフィアの10%)(図1H)、c-kit(図1I)、Sca-1 (図1J)、およびE-カドヘリン(図1K、骨髄由来スフィアの例)を発現した。すべてのスフィアであらゆる表面マーカーの発現は見られなかった。同じ組織からできたスフィアは<訳注:中身が>同一ではなく、もとの細胞の異種集団を含むようであった。形成されたスフィアの数は、最初蒔種された1000万個の細胞あたり116±5(n = 5)であった。 12週齢以上のマウスから細胞を調達した場合、生成されたスフィアの平均数は少なかった(補足図S1)。スフィアの形成の早い段階では、フローサイトメトリー分析で示されたように、含有された細胞は非常に小さく、大部分(すべての場合で60%〜70%内)直径が8µm未満であった。
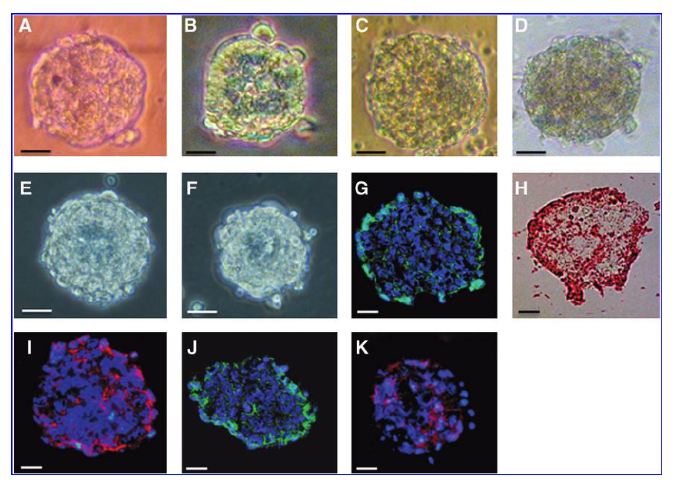
(原文)
FIG. 1. Sphere generation from adult bone marrow (scale bar, A–H 20mm). Primary spheres formed from nonadherent bone marrow cells at day 5 (A). Sphere formation from cells representative of different adult tissue types. Muscle, lung, and spinal cord were harvested with trituration and cultured in the maintain media. Spheres from all type of tissues arose within 5 days. Spinal spheres (SS) (B), myospheres (MS) (C), and pneumospheres (PS) (D) at day 5. Secondary spheres formed from cells dissociated from primary marrowspheres (E) and tertiary spheres formed from cells dissociated from secondary marrowspheres (F). Stage-specific embryonic antigen-1 expression is shown in green (G), alkaline phosphatase expression is shown in red (H), C-kit expression is shown in red (I), Sca-1 expression is shown in green (J), and E-cadherin expression is shown in red (K) in primary bone marrow spheres.
(和訳)
図1.成体骨髄からの球形成(スケールバー、A-H 20µm)。 5日目に非接着性骨髄細胞から形成された初代スフィア(A)。 異なる成体組織タイプを代表する細胞からのスフィア形成。 筋肉、肺および脊髄が粉砕で収集され、維持培地中で培養された。 すべてのタイプの組織からのスフィアは5日以内に生じた。 5日目の脊髄スフィア(SS)(B)、筋スフィア(MS)(C)および肺スフィア(PS)(D)。一次骨髄スフィアから解離した細胞から形成された二次スフィア(E)、および二次骨髄スフィアから解離した細胞から形成された三次スフィア(F)。一次骨髄スフィアから解離した細胞および二次球から分離した三次球 骨髄球(F)。 段階特異的胚抗原-1の発現は緑色(G)、アルカリホスファターゼ発現は赤色(H)、C-kit発現は赤色(I)、Sca-1発現は緑色(J) 、初代骨髄スフィアのE-カドヘリン発現は赤色(K)で示されている。
(原文)
Expression of embryonic-like phenotypes
Expression of the following genes normally associated with the early stage of embryonic development was seen in cells procured from each tissue. The gene profiles that were expressed are recognized as ESC markers and suggestive of pluripotency. Oct4, Nanog, Zfp296, Cripto, Gdf3, Utf1, Ecat1, Esg1, Sox2, and Fgf5 (Figs. 2 and 3) were expressed in cells procured from each tissue source. In contrast, Rex1, Eras, and Cdx2 were not expressed at the mRNA level (Figs. 2 and 3; Supplementary Table S2), suggesting that although the cells analyzed in the study were very similar to ESCs, they were not identical. Smaller spheres, <100mm in diameter, contained relatively higher proportion of cells expressing markers associated with ESCs. About 5%–10% of the spheres expressed Oct4 (Supplementary Table S2). In the cells that expressed Oct4, the gene profiles were quite similar to those expressed in primitive ectoderm during the early stage of embryonic development (Supplementary Table S3). Spheres seemed to contain heterogeneous populations of cells, with some markers expressed in some spheres, and other markers expressed in different spheres generated from cells isolated from the same tissue, at the same time.
(和訳)
胚様表現型の発現
胚発達の初期段階に通常関連する以下の遺伝子の発現が、各組織から調達された細胞において見られた。発現された遺伝子プロファイルは、ES細胞マーカーとして認識され、多能性が示唆されている。Oct4、Nanog、Zfp296、Cripto、Gdf3、Utf1、Ecat1、Esg1、Sox2、およびFgf5(図2および3)が各組織源から調達した細胞で発現した。対照的に、Rex1、ErasおよびCdx2はmRNAレベルで発現されなかった(図2および3;補足表S2)。この研究で分析された細胞はES細胞と非常に似ていたが、同一ではなかった。直径が100µm未満のより小さいスフィアは、ES細胞に関連するマーカーを発現する細胞の割合が比較的高かった。スフィアの約5%〜10%がOct4を示した(補足表S2)。 Oct4を発現する細胞では、胚発生の初期段階で原始外胚葉で発現された遺伝子プロフィールと非常によく似ていた(補足表S3)。スフィアは、あるスフィァではあるマーカー、同じ組織から同時に単離された細胞から生成された異なるスフィアでは他のマーカーというような異種細胞集団を含むようであった。
(原文)
The primitive ectoderm marker Fgf5 was frequently expressed, and pdgfa,a mesenchymal stem cell marker, was occasionally expressed (Figs. 2 and 3, Supplementary Table S2). Pdgfa-positive spheres were virtually negative for the mesoderm lineage marker Burachyury gene, which suggests that the spheres may contain precursors for mesenchymal stem cells.[21],[22] Expression of the neural stem cell marker, Nestin, was also documented after a few days in vitro, as well as the transcription genes Sox2, Pax6, and Eomes, critical in the development of the nervous system (Supplementary Table S2). During the early proliferation phase,especially in endodermal-and mesodermal-derived spheres, only 30% of spheres contained cells that expressed Nestin. Map2 and oligodendrocyte lineage transcription factor 2 (Olig2) were expressed only slightly, even when Nestin was also expressed (Supplementary Table S2). When cultured in the B27-supplemented serum-free medium used in this study, for >2 weeks without passaging, the gene expression profile demonstrated a reduction in ES marker gene expression and changed to a gene expression profile more similar to neural stem cells.
(和訳)
原始外胚葉マーカーFgf5はしばしば発現され、間葉系幹細胞マーカーであるpdgfaが時々発現された(図2および3、補足表S2)。 Pdgfa陽性球体は、中胚葉系統マーカーであるBurachyury遺伝子について事実上陰性であった。これは、スフィアが間葉系幹細胞の前駆体を含有する可能性があることを示唆している。[21],[22] 神経幹細胞マーカーNestinの発現もまた、神経系の発達に重要な転写遺伝子Sox2、Pax6、およびEomesと同様に試験管内で2,3日後に記録された(補足表S2)。初期の増殖期、特に内胚葉および中胚葉由来スフィアにおいて、スフィアの30%のみがネスチンを発現する細胞を含有していた。 Map2とoligodendrocyte lineage転写因子2(Olig2)はネスチンも発現していてもわずかに発現した(補足表S2)。この研究で使用されたB27補充無血清培地で、継代無しで 2週間まで培養すると、遺伝子発現プロファイルはESマーカー遺伝子発現の減少を示し、神経幹細胞により類似した遺伝子発現プロファイルに変化した。
(原文)
Differentiation potential of cells in vitro
Regardless of the tissue from which they had been isolated, some spheres <7 days old contained cells that expressed gene markers that have been associated with pluripotency. A few cells slightly expressed primitive markers of the three germ layers (Map2, Brachyury, and Gata6) (Supplementary Table S2). Consequently, the potential to differentiate into cells representative of the three germ layers was examined.
(和訳)
試験管内細胞分化能
それらが単離された組織とは無関係に、7日未満のいくつかのスフィアは多能性に関連する遺伝子マーカーを発現する細胞を含んでいた。 いくつかの細胞が三胚葉の原始マーカーをわずかに発現した(Map2、Brachyury、およびGata6)(補足表S2)。 その結果、三胚葉を代表する細胞に分化する可能性が検討された。

(原文)
FIG. 2. Gene expression profiles of cell contained in bone marrow spheres. Gene expression of each bone marrow sphere was analyzed by reverse transcription-polymerase chain reaction. Gene expression of cells in each bone marrow sphere was compared to those of embryonic stem cells.
(和訳)
図2.骨髄球に含まれる細胞の遺伝子発現プロフィール。 各骨髄球の遺伝子発現を、逆転写ポリメラーゼ連鎖反応によって分析した。 各骨髄球における細胞の遺伝子発現をES細胞のものと比較した。
(原文)
FIG. 3. Gene expression profiles of oct4-expressing cells in spheres from each tissue. Spinal spheres (SS), myospheres (MS), and pneumospheres (PS) at day 5 were compared to those of embryonic stem cells.
(和訳)
図3.各組織からのスフィアのoct4発現している細胞の遺伝子発現プロファイル。 5日目の脊髄球(SS)、筋球(MS)および肺球(PS)をES細胞のものと比較した。
(原文)
Marrow-derived cells
When representative BM-derived spheres were dissociated into single cells and exposed to three different differentiation media, the cells differentiated to express specific genes of the three lineages, Map2 (ectoderm), MyoD (mesoderm), and AFP (endoderm). This is in contrast to undifferentiated spheres, which did not contain cells that expressed any of the specific genes associated with each lineage, that is, Map2, MyoD, and AFP (Fig. 4A). The addition of a neural differentiation medium to the in vitro environment of cells from BM spheres resulted in expression of bIII tubulin (a marker for neuron) (Fig. 4B), GFAP (for glia) (Fig. 4C), and O4 (representative of oligodendrocytes)(Fig.4D).
(和訳)
骨髄由来細胞
代表的な骨髄由来のスフィアを単一細胞に解離し、3つの異なる分化培地に置くと、細胞は分化して、Map2(外胚葉)、MyoD(中胚葉)、およびAFP(内胚葉)の三系統の特定遺伝子を発現した。 これは、各系統に関連する特定の遺伝子、すなわちMap2、MyoD、およびAFPを発現する細胞を含まない未分化スフィア(図4A)とは対照的である。 骨髄スフィアからの細胞の試験管内環境への神経分化培地の添加は、bIIIチューブリン(神経のマーカー)(図4B)、GFAP(神経膠細胞のマーカー)(図4C)、およびO4 (乏突起膠細胞を代表する)(図4D)の発現を結果した。
(原文)
Alternatively,the addition of 20% fetal calf serum to the media resulted in expression of markers representative of mesoderm, that is, a-smooth muscle actin (Fig. 4E), myosin (Fig. 4F), and desmin (Fig. 4G) as well as the mesenchymal cells, chondrocytes, osteocytes, and adipocytes (Supplementary Fig. S2A–C). Thus, cells from spheres differentiated into all cell types of neural (neurons, oligodendrocytes, and glias) and mesenchymal stem cell lineage (chondrocytes, osteocytes, and adipocytes). When exposed to a hepatocyte differentiation media, expression of AFP (Fig. 4H),albumin(Fig.4I), andCK18(Fig.4J) wasseen, suggestive of differentiation into endodermal tissue.
(和訳)
代わりに、培地に20%ウシ胎仔血清を添加すると、間葉細胞、軟骨細胞、骨細胞、および脂肪細胞(補足図S2A〜C)と同様に、中胚葉を表すマーカー、すなわちα-平滑筋アクチン(図4E)、ミオシン(図4F)、およびデスミン(図4G)、の発現がもたらされた。 したがって、スフィアからの細胞は、神経系統(神経細胞、乏突起膠細胞および神経膠細胞)および間葉系幹細胞系統(軟骨細胞、骨細胞および脂肪細胞)の すべての細胞系統に分化したことになる。肝細胞分化培地に置くと、AFP(図4H)、アルブミン(図4I)、およびCK18(図4J)の発現が見られ、内胚葉組織への分化が示唆された。
(原文)
Cells derived from tissues representative of the three germ layers
Spinal spheres, myospheres, and pneumospheres were then exposed to the same three differentiation media. Neural cells (ectoderm lineage) expressing the neural cell marker, bIII tubulin (Fig. 5Ai–Ci), the glial cell marker, GFAP (Fig. 5Aii–Cii), and the oligodendrocyte marker, O4 (Fig. 5Aiii– Ciii), were identified when the spheres were exposed to a neural differentiating media. Muscle cells (mesodermal lineage) expressing a-smooth muscle actin (Fig. 5Aiv–Civ), myosin (Fig. 5Av–Cv), and desmin (Fig. 5Avi–Cvi) were identified when the spheres were exposed to a muscle differentiating media. Other mesenchymal lineage cells such as chondrocytes, osteocytes, and adipocytes (Supplementary Fig. S2D–I) were also observed. When spheres were exposed to a hepatocyte differentiating media, differentiated into hepatocyte (endoderm lineage), expression of AFP (Fig. 5Avii–Cvii), albumin (Fig. 5Aviii–Cviii), and CK18 (Fig. 5Aix–Cix) was seen.
(和訳)
三胚葉を代表する組織に由来する細胞
脊椎スフィア、筋スフィアおよび肺スフィアを同じ3つの分化培地に置いた。神経分化培地に置かれた結果、神経細胞マーカーであるbIIIチューブリン(図5Ai-Ci)、神経膠細胞マーカーであるGFAP(図5Aii-Cii)および乏突起膠細胞マーカーであるO4(図5Aii-Ciii)が同定された。スフィアを筋肉分化培地に置いた結果、平滑筋アクチン(図5Aiv-Civ)、ミオシン(図5Av-Cv)およびデスミン(図5Avi-Cvi)が同定された。軟骨細胞、骨細胞および脂肪細胞などの他の間葉系統細胞(補足図S2D-1)も観察された。スフィアを肝細胞分化培地に置き、肝細胞(内胚葉系統)に分化させると、AFP(図5Avii-Cvii)、アルブミン(図5Aviii-Cviii)、およびCK18(図5Aix-Cix)の発現が見られた。
(原文)
The potential for multi-differentiation of cells contained in spheres that had been procured from tissues representative of the three germ layers seemed to possess the same differentiation potential as did cells procured from BM.
(和訳)
三胚葉を代表する組織から調達されたスフィアに含まれる細胞の多分化能は、骨髄から調達された細胞と同じ分化能であるように思われた。
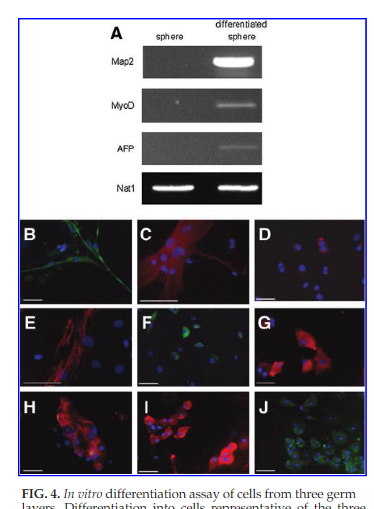
(原文)
FIG. 4. In vitro differentiation assay of cells from three germ layers. Differentiation into cells representative of the three germ layers was confirmed by each specific gene expression of various lineages: Map2 (ectoderm), MyoD (mesoderm), and AFP (endoderm); however, nondifferentiated spheres did not express any of Map2, MyoD, and AFP (A). Marrowspheres were dissociated and plated in each appropriate medium. Cells from spheres differentiated into cells representative of the three germ layers: neural cells (B–D), muscle cells (E–G), and hepatocytes (H–J). Neurons stained with bIII tubulin (B), glias stained with GFAP (C), and oligodendrocytes were stained with O4 (D). Muscle cells stained with αsmooth muscle actin (E) and myosin (F) and desmin (G). Hepatocytes were stained with AFP (H), albumin (I), and CK18 (J). AFP, α-fetoprotein; Map2, microtubule-associated protein 2; GFAP, glial fibrillary acidic protein; CK18, cytokeratin 18.
(和訳)
図4.三胚葉由来細胞の試験管内分化実験。三胚葉を代表する細胞への分化は、種々の系統のそれぞれの特定の遺伝子発現によって確認された:Map2(外胚葉)、MyoD(中胚葉)およびAFP(内胚葉);しかし、非分化スフィアは、Map2、MyoD、およびAFP(A)のいずれも発現しなかった。骨髄スフィアを解離させ、各適切な培地に蒔いた。 スフィア由来細胞は、神経細胞(B-D)、筋細胞(E-G)、および肝細胞(H-J)の三胚葉を代表する細胞に分化した。 bIIIチューブリン(B)で染色された神経、GFAP(C)で染色された神経膠細胞、乏突起膠細胞はO4(D)で染色した。 筋肉細胞は、α平滑筋アクチン(E)およびミオシン(F)およびデスミン(G)で染色された。 肝細胞はAFP(H)、アルブミン(I)、およびCK18(J)で染色された。 AFP=α-fetoprotein; Map2=microtubule-associated protein 2<微小管結合タンパク質2>; GFAP=glial fibrillary acidic protein<グリア線維性酸性タンパク質>; CK18=cytokeratin 18。
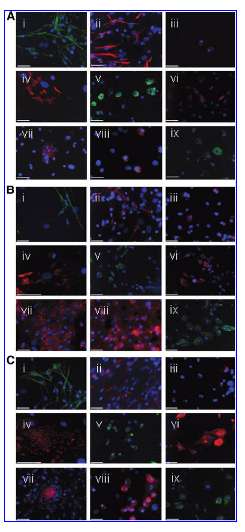
FIG.5
(原文)
FIG. 5. Differentiation assay of spheres derived from different adult tissue types into cells representative of the three germ layers. Differentiation assay from spinal spheres (A) into neural cells (i, ii, and iii), muscle cells (iv, v, and vi), and hepatocytes (vii, viii, and ix). bIII tubulin-expressing neurons are shown in green (i), GFAP-expressing glias are shown in red (ii), and O4-expressing oligodendrocytes are shown in red(iii).α-smooth muscle actin-expressing smooth muscle cells are shown in red(iv), myosin-expressing cells are shown in green (v), and desmin-expressing cells are shown in red (vi). AFP-expressing cells are shown in red(vii),albumin-expressing cells are shown in red(viii),and CK18 are shown in green(ix).
Differentiation assay from pneumospheres (B) into neural cells (i, ii, and iii), muscle cells (iv, v, and vi), and hepatocytes (vii, viii, and ix). bIII tubulinexpressing neurons are shown in green (i), GFAP-expressing glias are shown in red (ii), and O4-expressing oligodendrocytes are shown in red (iii). a-smooth muscle actin-expressing smooth muscle cells are shown in red (iv), myosin-expressing cells are shown in green (v), and desmin-expressing cells are shown in red (vi). AFP-expressing cells are shown in red (vii), albumin expressing cells are shown in red(viii),and CK18 are shown in green(ix).
Differentiation assay from myospheres(C) into neural cells(i,ii,and iii),muscle cells(iv,v,and vi)cells,and hepatocytes(vii,viii,and ix).bIII tubulin-expressing neurons are shown in green (i), GFAP-expressing glias are shown in red (ii), and O4-expressing oligodendrocytes are shown in red (iii). a-smooth muscle actin-expressing smooth muscle cells are shown in red(iv),myosin-expressing cells are shown in green(v),and desmin expressing cells are shown in red (vi). AFP-expressing cells are shown in red (vii), albumin-expressing cells are shown in red (viii), and CK18 are shown in green (ix). Nuclei were stained with 4',6-diamidino-2-phenylindole (DAPI). Scale bars: 50mm.
(和訳)
図5.異なる成体組織系統由来スフィアから三胚葉を代表する細胞への分化実験。脊髄スフィア(A)から神経細胞(i、ii、およびiii)、筋肉細胞(iv、vおよびvi)、および肝細胞(vii、viiiおよびix)への分化実験。bIIIチューブリン発現ニューロンは緑色(i)、GFAP発現神経膠細胞は赤色(ii)、O4発現乏突起膠細胞は赤色(iii)で示されている。Α-平滑筋アクチン発現平滑筋細胞は赤色(iv)、ミオシン発現細胞は緑色(v)、デスミン発現細胞は赤色(vi)で示されている。 AFPを発現する細胞は赤色(vii)、アルブミンを発現する細胞は赤色(viii)、CK18は緑色(ix)で示されている。
肺スフィア(B)から神経細胞(i、ii、およびiii)、筋肉細胞(iv、v、及びvi)、及び肝細胞(vii、viii、及びix)への分化実験。bIIIチューブリン発現神経細胞は緑色(i)、GFAP発現神経膠細胞は赤色(ii)、O4発現性乏突起膠細胞は赤色(iii)で示されている。 α-平滑筋アクチン発現平滑筋細胞は赤色(iv)、ミオシン発現細胞は緑色(v)、デスミン発現細胞は赤色(vi)で示されている。AFP発現細胞は赤色(vii)、アルブミン発現細胞は赤色(viii)、CK18は緑色(ix)で示している。
筋肉スフィア(C)から内膜細胞(i、ii、andiii)、筋肉細胞(iv、v、およびvi)および肝細胞(vii、viii、およびix)への分化実験。bIIIチューブリン発現神経細胞は緑色(i)、GFAP発現神経膠細胞は赤色(ii)、およびO4発現性乏突起膠細胞は赤色(iii)で示されている。Α-平滑筋アクチン発現平滑筋細胞は赤色(iv)、ミオシン発現細胞は緑色(v)、デスミン発現細胞は赤色(vi)で示されている。 AFP発現細胞は赤色(vii)、アルブミン発現細胞は赤色(viii)、CK18は緑色(ix)で示されている。 細胞核は4',6-diamidino-2-phenylindole (DAPI)で染色された。 スケールバー:50µm。
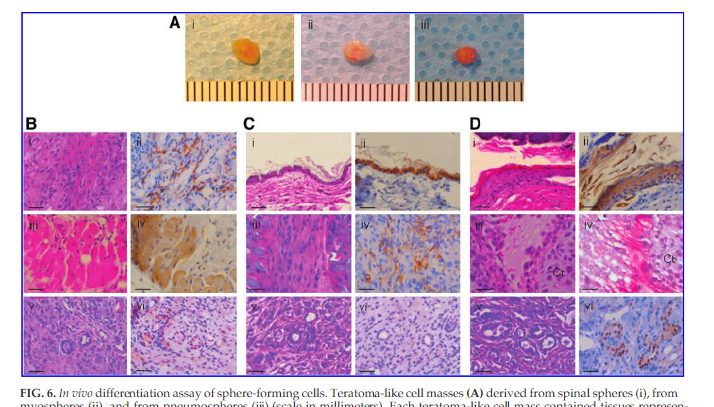
(原文)
FIG. 6. In vivo differentiation assay of sphere-forming cells.Teratoma-like cell masses(A) derived from spinal spheres (i), from myospheres (ii), and from pneumospheres (iii) (scale in millimeters). Each teratoma-like cell mass contained tissues representative of all three germ layers. Teratoma-like tissue from spinalspheres (B) contained nerve (i) expressing betaIII-tubulin (ii) (ectoderm), muscle (iii) expressing desmin (iv) (mesoderm), and duct-like structure (v) expressing FOXA2 (vi) (endoderm). Teratoma-like tissue from myospheres (C) contained epithelium (i) expressing pancytokeratin (ii) (ectoderm), muscle (iii) expressing a-smooth muscle actin(iv)(mesoderm),and a duct-like structure(v)expressing FOXA2(vi)(endoderm).Teratoma-like tissue from pneumospheres (D) contained epithelium (i) expressing pancytokeratin (ii) (ectoderm), cartilage (Ct) (iii) demonstrating safranin O staining (iv) (mesoderm),and gland-like structures(v)expressing FOXA2(vi) (endoderm). Scale bars:50µm.
(和訳)
図6. スフィア形成細胞の生体内分化実験。神経スフィア(i)、筋スフィア(ii)および肺スフィア(iii)由来のテラトーマ様細胞塊(A)(単位ミリメートル)。 各奇形腫様細胞塊は、三胚葉すべてを代表する組織を含んでいた。、βIII-チューブリン(ii)を発現する神経(i)(外胚葉)、デスミン(iv)を発現する筋肉(iii)(中胚葉)、およびFOXA2 (vi)を発現するダクト様構造(v)(内胚葉)を含む脊髄スフィア由来テラトーマ様組織(B)。汎サイトケラチン (ii)を発現する上皮(i)(外胚葉)、平滑筋肉アクチン(iv)を発現する筋肉(iii)(中胚葉)、およびFOXA2(vi)を発現するダクト様構造(v)(内胚葉)を含む筋肉スフィア由来テラトーマ様組織(C)。汎サイトケラチン (ii)を発現する上皮(i)(外胚葉)、サフラニンO染色(iv) を示す軟骨(Ct) (iii)(中胚葉)、およびFOXA2 (vi)を発現する腺様構造(v)(内胚葉)を含む肺球スフィア由来テラトーマ様組織(D)。 スケールバー:50μm。
(原文)
Differentiation potential of cells in vivo
When implanted subcutaneously into NOD/SCID mice, spheres generated from cells procured from each of the three germ layers demonstrated the potential to form tissue-like teratoma. containing cells representative of all three germ layers. The tissues generated were encapsulated and easily resected. Each explant was ~25㎣(Fig. 6A). Individual explants contained cells representative of all three germ layers. Tissue generated from spinal spheres contained nerve (ectoderm; Fig. 6Bi, Bii), muscle (mesoderm; Fig. 6Biii, Biv), and duct-like tissue (endoderm; Fig. 6Bv, Bvi). Tissue generated from myospheres contained epithelium (ectoderm; Fig. 6Ci, Cii), muscle (mesoderm; Fig. 6Ciii, Civ), and ductlike tissue (endoderm; Fig. 6Cv, Cvi). Tissue generated from pneumospheres contained epithelium (ectoderm; Fig. 6Di, Dii), cartilage (mesoderm; Fig. 6Diii, Div), and gland (ectoderm; Fig. 6Dv, Dvi). Specific tissues were identified using immunohistochemical techniques. Nerves were identified using beta III-tubulin, epithelium identified using pancytokeratin, and muscle identified using desmin and myosin. Duct-like structures and gland were identified using FOXA2.
(和訳)
細胞の生体内分化能力
NOD / SCIDマウスに皮下移植した結果、それぞれの三胚葉から調達された細胞から形成されたスフィアは、三胚葉全てを代表する細胞を含むテラトーマ様細胞の形成能を示した。生成された組織はカプセル化されており、容易に切除された。各移植片は最大25立方ミリであった(図6A)。 個々の移植片は三胚葉全てを代表する細胞を含んでいた。 脊髄球から形成された組織は、神経(外胚葉;図6Bi、Bii)、筋肉(中胚葉;図6Biii、Biv)および管様組織(内胚葉;図6Bv、Bvi)を含んでいた。 筋肉から形成された組織は、上皮(外胚葉;図6Ci、Cii)、筋肉(中胚葉;図6Ciii、Civ)および管状組織(内胚葉;図6Cv、Cvi)を含んでいた。 肺球から生成された組織は、上皮(外胚葉;外胚葉;図6Di、Dii)、軟骨(中胚葉;図6Diii、Div)および腺(外胚葉;図6Dv、Dvi)を含んでいた。 免疫組織化学的手法を用いて特定の組織を同定した。神経は βIII-チューブリンを用いて同定し、上皮は汎サイトケラチンを用いて同定し、筋肉はデスミンおよびミオシンを用いて同定した。 ダクト様の構造および腺はFOXA2を用いて同定した。
(原文)
Discussion
In one of the first reports, adult stem cells isolated from the central nervous system (an ectodermal-derived tissue) were shown to form spheres containing cells that express Nestin, a neural stem cell marker.[23] These cells are now well known to be capable of multi-lineage differentiation(multipotency) into neurons, astrocytes, and oligodendrocytes.[24] They reportedly have the potential to differentiate into all cells of the embryo body[25] and into cells representative of all three germ layers in vitro.[26] When injected into early stage embryos in vivo, they contribute to the generation of chimeric mice and contribute to tissue formation of the three germ layers.[25] These studies suggest that the cells procured from tissue derived from ectoderm, and propagated as neurospheres retain a fairly immature state. We believe that our report is the first description of spheres being generated from tissue representative of ectoderm, endoderm, and mesoderm having similar potentials.
(和訳)
討論
初期報告の1つでは、中枢神経系(外胚葉由来組織)から単離された成体幹細胞が神経幹細胞マーカーであるネスチンを発現する細胞を含むスフィアを形成することが示されている。[23] これらの細胞は、今や、ニューロン、星状細胞および希突起膠細胞への多系統分化(多分化能)が可能であることがよく知られている。[24] それらは伝えられるところでは、胚[25] のすべての細胞に分化する可能性と、試験管内で三胚葉すべてを代表する細胞に分化する可能性を持っている。[26] インビボで初期胚に注入すると、それらはキメラマウスの生成に寄与し、3つの胚葉の組織形成に寄与する。[25] これらの研究は、外胚葉に由来し、神経スフィアとして増殖した組織から調達された細胞がかなり未熟な状態を保持していることを示唆している。私たちは、私たちの報告が同様の能力を持つ外胚葉、内胚葉、および中胚葉を代表する組織から生成されたスフィアの最初の記述であると考えている。
(原文)
There are significant differences between the cells described in this report and ESCs. While the cells studied expressed many of the common cell markers associated with ESCs, they did not express all of them. Cells contained within the spheres did not express Rex1 (also known as Zfp42), a phenomenon also observed in the development of primitive ectoderm.[27],[28] During embryonic development, cavitation results from apoptotic cell death of the inner part of the epiblast cells. Cells surviving in the outer layer of the epiblast then form a columnar epithelium, defined as the primitive ectoderm (Oct4+, Rex1-, and Fgf5+), which gives rise to the embryo proper.[29] Formation of embryonic bodies (EB) using ESCs can mimic peri-implantation development in vitro, which has been utilized for both transient expression of primitive ectoderm-like gene expression (Oct4+, Rex1-, and Fgf5+) and induction of somatic cells.[30] Consequently, since ESCs pass though the primitive ectoderm state during the development of somatic tissue, primitive ectoderm may be the source for all adult stem cells found in somatic tissues. As many of the cells described in this report express markers associated with primitive ectoderm, in that they are Oct4+, Rex1-, and Fgf5+, we believe that the spheres described in this report contain common stem cells for all somatic cells. It has been controversial as to whether Oct4-expressing cells reside in adult tissue. While a few reports, which have not been well documented, support the existence of Oct4-expressing cells in BM, others have suggested that ES-like cells do reside in the adult body.[5]
(和訳)
この報告書に記載されている細胞とES細胞との間には大きな隔たりがある。研究された細胞は、ES細胞に関連する多くの共通の細胞マーカーを発現したが、それらのすべては発現しなかった。スフィア内に含まれる細胞は、原始外胚葉の発達においても観察された現象であるRex1(Zfp42としても知られている)を発現しなかった。[27],[28] 胚発生の間、空洞化が胚盤葉細胞の内部のアポトーシス細胞死に起因して起きる。Epiblastの外層に生き残った細胞は胚そのものから生み出された原始外胚葉(Oct4 +、Rex1-、Fgf5 +)と定義され、柱状上皮を形成する。[29] ES細胞を用いた胚体(EB)形成は試験管内での着床周辺発生を模倣することができるので、原始外胚葉様遺伝子発現(Oct4 +、Rex1-、およびFgf5 +)の一過性発現および体細胞誘導の両方をみるために利用されている。[30] 結果的にES細胞は体細胞の発達中に原始外胚葉状態を経過するので、原始外胚葉は体細胞に見出される全ての成体幹細胞の供給源である可能性がある。このレポートに記載されている細胞の多くは原始外胚葉に関連するマーカーを発現しているので、それらがOct4+、Rex1-、およびFgf5+であるという点で、この報告書に記載されているスフィアはすべての体細胞にとっての共通の幹細胞を含むと考えられる。 Oct4発現細胞が成体組織に存在するかどうかが議論されてきている。十分に実証されていないが、いくつかの報告は、骨髄の中でのOct4発現細胞の存在を支持しているが、他の研究者はES様細胞が成体で存在することを示唆している。[5}
(原文)
Since the spheres in this study contained cells with a differentiation potential that appear to fulfill the criteria for both mesenchymal stem cells and neural stem cells, we believe that the spheres contain precursor cells to both mesenchymal and neural stem cells lineages. The cells were propagated as nonadherent spheres, which are not known to exist in vivo. The in vitro behavior of cells contained in the spheres is likely to be very different from cells that reside in vivo, and the spheres generated seemed to be composed of heterogeneous populations of cells. The authors believe that it is important to the self-renewing, clonal analysis, and chimera studies to determine whether or not these are indeed true stem cells. Some markers were expressed in some spheres, whereas other markers expressed in different spheres generated from cells isolated from the same tissue, at the same time. We believe that these differences also may be a function of the environment in which the cells were maintained. Propagation of cells as nonadherent spheres in a basic serum-free, FGF-dependant media maintained cells expressing gene markers associated with immature cells for a short period, in contrast to the use of a pluripotent maintaining culture media containing leukemia inhibitory factor (LIF), which resulted in a higher proportion of cells expressing immature markers for a longer period.
(和訳)
本研究のスフィアには、間葉系幹細胞と神経幹細胞の両方の基準を満たすように見える分化能を有する細胞が含まれていたため、スフィアには間葉系幹細胞系統と神経幹細胞系統の前駆細胞が含まれていると考えられる。細胞は非接着性スフィアとして増殖し、生体内で存在することは知られていない。スフィアに含まれる細胞の試験管内挙動は生体内に存在する細胞とは非常に異なる可能性があり、かつ生成されたスフィアは異種細胞集団から構成されているようである。著者らは、これらが実際に真の幹細胞であるかどうかを決定することは、自己増殖、クローン分析、およびキメラ研究にとって重要であると考えている。いくつかのマーカーがいくつかのスフィァで発現されたが、一方同じ組織から単離された細胞由来の異なるスフィアでは他のマーカーも同時に発現した。これらの違いは、細胞が維持されている環境の関数でもあると我々は考えている。 未成熟マーカーをより長く発現している細胞の割合がより高くなる、白血病抑制因子(LIF)を含む多能性維持培地の使用とは対照的に、ベーシック無血清FGF依存性培地中の非付着性スフィアとしての細胞の増殖は短い期間未熟細胞に関連する遺伝子マーカーを発現する細胞を維持した。
(原文)
Although the spheres in this study described were capable of generating teratoma-like tissue, the transplanted cells did not form large teratomas as did ES cells, nor they did express Eras in vitro as ESCs,[31] which suggests that the teratoma-like tissue they generate may be very different from true teratomas generated from ESCs. In addition, the cells studied did not express the trophectoderm marker Cdx2[32 ]or also associated with ESCs. These differences of gene expression pattern may explain the differences of the biological function between ESCs and adult stem cells in this study.
(和訳)
この研究のスフィアはテラトーマ様組織を形成することができたが、移植された細胞はES細胞ほどには大きなテラトーマを形成せず、また試験管内実験でES細胞のようにErasを発現することはなかった、[31] またそれはスフィアの作り出したテラトーマ様組織が ES細胞から形成される真のテラトーマとは大きく異なる可能性を示唆している。 加えてここで研究された細胞は栄養外胚葉マーカーであり、またES細胞にも関連しているCdx2「32」を発現しなかった。遺伝子発現パターンのこれらの違いは、ES細胞とこの研究における成体幹細胞との間の生物学的機能の差異を説明しているのかもしれない。
(原文)
To fully document the true potential of these cells or that they exist in vivo is important issue for future studies. There exists a heterogeneous population of cells in adult tissues possessing properties more similar to those of ESCs than previously believed. There are, however, significant differences between this population of adult stem cells and ESCs. The population of cells described expresses many protein markers in common with ESCs and, when procured from tissues derived from each of the three germ layers, has the potential to mature into cells representative of the three germ layers, both in vitro and in vivo. The findings are consistent with recent reports that ESCs are heterogeneous rather than homogeneous when maintained in pluripotency culture conditions. Different cells within the spheres are likely to have different potentials. These observations suggest that status of both undifferentiated ES cells and the cells described in this report are in a constant state of fluctuation.[33] The environment in which the cells live may be the most crucial factor in how they develop, or which populations of cells in these heterogeneous spheres are selected to develop.
(和訳)
これらの細胞の真の能力もしくは生体内に存在していることを完全に証明することは将来の研究にとって重要な問題である。以前に考えられていたよりもES細胞により類似した特性を有する成体組織における異種細胞混交集団が存在する。しかし、この成体幹細胞集団とES細胞との間には大きな違いがある。ここで述べられた細胞集団はES細胞と共通の多くのタンパク質マーカーを発現し、三胚葉のそれぞれに由来する組織から調達されたとき、生体内および試験管内の両方で三胚葉を代表する細胞に成熟する能力を持つ。この発見は、ES細胞が多分化能培養条件下で維持されたとき、同一種構成ではなく異種構成であるという最近の報告と一致する。スフィア内の異なる細胞は異なる能力を有する可能性が高い。これらの所見は、未分化のES細胞およびこの報告書に記載されている細胞の状態が一定の変異内にあることを示唆している。細胞が生息する環境こそ、その中でそれらがどのように発達するのか、或いは、これらの異種スフィアにおいてどの細胞集団が選択されて発育するのかの、最も重要な因子であり得る。
(原文)
Acknowledgments
The authors thank Selena Liao for comments on the article, Jason D. Ross, and Ana C. Paz, Ashley Penvose, and Peter Schow for extensive technical assistance and animal care. This work was supported by the Department of Anesthesiology, Perioperative and Pain Medicine at Brigham and Women’s Hospital in Boston.
(和訳)
謝辞
著者は論文への助言に関してSelena Liaoに、幅広い技術援助と動物のケアに関してJason D. Ross、Ana C. Paz、Ashley Penvose、Peter Schowに謝意を表明する。この仕事は、ボストンのブリガム・アンド・ウィミンズ病院の麻酔、手術期管理および痛み医療学部によって支援された。
(原文)
Disclosure Statement
The corresponding author, Charles A. Vacanti, has applied for patents for some of the technology described, through the University of Massachusetts. Some of the pending patents have been licensed to a company, Celthera.
(和訳)
開示報告
責任著者、Charles A. Vacantiは、マサチューセッツ大学を通じて、記載されている技術のいくつかの特許を申請している。 保留中の特許の一部は、Celthera社にライセンス供与されている。
(原文)
References
1. Takahashi, K., and Yamanaka, S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell 126, 663, 2006.
2. Vacanti, M.P., Roy, A., Cortiella, J., Bonassar, L., and Vacanti, C.A. Identification and initial characterization of spore-like cells in adult mammals. J Cell Biochem 80, 455, 2001.
3. Toma, J.G., Akhavan, M., Fernandes, K.J., Barnabe-Heider, F., Sadikot, A., Kaplan, D.R., and Miller, F.D. Isolation of multipotent adult stem cells from the dermis of mammalian skin. Nat Cell Biol 3, 778, 2001.
4. Kucia,M.,Reca,R.,Campbell,F.R.,Zuba-Surma,E.,Majka,M., Ratajczak, J., and Ratajczak, M.Z. A population of very small embryonic-like (VSEL) CXCR4(þ)SSEA-1(þ)Oct-4þ stem cells identified in adult bone marrow. Leukemia 20, 857, 2006.
5. Jiang, Y., Jahagirdar, B.N., Reinhardt, R.L., Schwartz, R.E., Keene, C.D., Ortiz-Gonzalez, X.R., Reyes, M., Lenvik, T., Lund, T., Blackstad, M., Du, J., Aldrich, S., Lisberg, A., Low, W.C., Largaespada, D.A., and Verfaillie, C.M. Pluripotency of mesenchymal stem cells derived from adult marrow. Nature 418, 41, 2002. .
6. Tropepe, V., Coles, B.L., Chiasson, B.J., Horsford, D.J., Elia, A.J., McInnes, R.R., and van der Kooy, D. Retinal stem cells in the adult mammalian eye. Science 287, 2032, 2000
7. Kukekov, V.G., Laywell, E.D., Thomas, L.B., and Steindler, D.A. A nestin-negative precursor cell from the adult mouse brain gives rise to neurons and glia. Glia 21, 399, 1997.
8. Chiasson, B.J., Tropepe, V., Morshead, C.M., and van der Kooy, D. Adult mammalian forebrain ependymal and subependymal cells demonstrate proliferative potential, but only subependymal cells have neural stem cell characteristics. J Neurosci 19, 4462, 1999.
9. Brazel, C.Y., Limke, T.L., Osborne, J.K., Miura, T., Cai, J., Pevny, L., and Rao, M.S. Sox2 expression defines a heterogeneous population of neurosphere-forming cells in the adult murine brain. Aging Cell 4, 197, 2005.
10. Osterberg, N., and Roussa, E. Characterization of primary neurospheres generated from mouse ventral rostral hindbrain. Cell Tissue Res 336,
11, 2009. 11. Uchida, S., Yokoo, S., Yanagi, Y., Usui, T., Yokota, C., Mimura, T., Araie, M., Yamagami, S., and Amano, S. Sphere formation and expression of neural proteins by human corneal stromal cells in vitro. Invest Ophthalmol Vis Sci 46, 1620, 2005.
12. Lord-Grignon, J., Abdouh, M., and Bernier, G. Identification of genes expressed in retinal progenitor/stem cell colonies isolated from the ocular ciliary body of adult mice. Gene Expr Patterns 6, 992, 2006.
13. Doyle, K.L., Kazda, A., Hort, Y., McKay, S.M., and Oleskevich, S. Differentiation of adult mouse olfactory precursor cells into hair cells in vitro. Stem Cells 25, 621, 2007.
14. Lehnert, L., Trost, H., Schmiegel, W., Roder, C., and Kalthoff, H. Hollow-spheres: a new model for analyses of differentiation of pancreatic duct epithelial cells. Ann NY Acad Sci 880, 83, 1999.
15. Kawase, Y., Yanagi, Y., Takato, T., Fujimoto, M., and Okochi, H. Characterization of multipotent adult stem cells from the skin: transforming growth factor-beta (TGF-beta) facilitates cell growth. Exp Cell Res 295, 194, 2004.
16. Wong, C.E., Paratore, C., Dours-Zimmermann, M.T., Rochat, A., Pietri, T., Suter, U., Zimmermann, D.R., Dufour, S., Thiery, J.P., Meijer, D., Beermann, F., Barrandon, Y., and Sommer, L. Neural crest-derived cells with stem cell features can be traced back to multiple lineages in the adult skin. J Cell Biol 175, 1005, 2006.
17. Tamaki, T., Okada, Y., Uchiyama, Y., Tono, K., Masuda, M., Wada, M., Hoshi, A., Ishikawa, T., and Akatsuka, A. Clonal multipotency of skeletal muscle-derived stem cells between mesodermal and ectodermal lineage. Stem Cells 25, 2283, 2007.
18. Shiota, M., Heike, T., Haruyama, M., Baba, S., Tsuchiya, A., Fujino, H., Kobayashi, H., Kato, T., Umeda, K., Yoshimoto, M., and Nakahata, T. Isolation and characterization of bone marrow-derived mesenchymal progenitor cells with myogenic and neuronal properties. Exp Cell Res 313, 1008, 2007.
19. Hermann, A., Gastl, R., Liebau, S., Popa, M.O., Fiedler, J., Boehm, B.O., Maisel, M., Lerche, H., Schwarz, J., Brenner, R., and Storch, A. Efficient generation of neural stem cell-like cells from adult human bone marrow stromal cells. J Cell Sci 117, 4411, 2004.
20. Hitoshi, S. [The generation of neural stem cells: induction of neural stem cells from embryonic stem (ES) cells]. Rinsho Shinkeigaku 43, 827, 2003.
21. Morikawa, S., Mabuchi, Y., Niibe, K., Suzuki, S., Nagoshi, N., Sunabori, T., Shimmura, S., Nagai, Y., Nakagawa, T., Okano, H., and Matsuzaki, Y. Development of mesenchymal stem cells partially originate from the neural crest. Biochem Biophys Res Commun 379, 1114, 2009.
22. Takashima,Y.,Era,T.,Nakao,K.,Kondo,S.,Kasuga,M.,Smith, A.G., and Nishikawa, S. Neuroepithelial cells supply an initial transient wave of MSC differentiation. Cell 129, 1377, 2007.
23. Reynolds, B.A., and Weiss, S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science 255, 1707, 1992.
24. Gage, F.H. Mammalian neural stem cells. Science 287, 1433, 2000.
25. Clarke, D.L., Johansson, C.B., Wilbertz, J., Veress, B., Nilsson, E., Karlstrom, H., Lendahl, U., and Frisen, J. Generalized potential of adult neural stem cells. Science 288, 1660, 2000.
26. Rietze, R.L., Valcanis, H., Brooker, G.F., Thomas, T., Voss, A.K., and Bartlett, P.F. Purification of a pluripotent neural stem cell from the adult mouse brain. Nature 412, 736, 2001.
27. Rogers, M.B., Hosler, B.A., and Gudas, L.J. Specific expression of a retinoic acid-regulated, zinc-finger gene, Rex-1, in preimplantation embryos, trophoblast and spermatocytes. Development 113, 815, 1991.
28. Pelton, T.A., Sharma,S., Schulz, T.C.,Rathjen, J., and Rathjen, P.D. Transient pluripotent cell populations during primitive ectoderm formation: correlation of in vivo and in vitro pluripotent cell development. J Cell Sci 115, 329, 2002.
29. Haub, O., and Goldfarb, M. Expression of the fibroblast growth factor-5 gene in the mouse embryo. Development 112, 397, 1991.
30. Keller, G. Embryonic stem cell differentiation: emergence of a new era in biology and medicine. Genes Dev 19, 1129, 2005.
31. Takahashi, K., Mitsui, K., and Yamanaka, S. Role of ERas in promoting tumour-like properties in mouse embryonic stem cells. Nature 423, 541, 2003.
32. Ralston, A., and Rossant, J. Genetic regulation of stem cell origins in the mouse embryo. Clin Genet 68, 106, 2005.
33. Toyooka, Y., Shimosato, D., Murakami, K., Takahashi, K., and Niwa, H. Identification and characterization of subpopulations in undifferentiated ES cell culture. Development 135, 909, 2008.
(和訳)
参考文献
1. Takahashi, K., and Yamanaka, 定義された因子によるマウス胚性および成体線維芽細胞培養からの多能性幹細胞の誘導。 Cell 126,663,2006。
2. Vacanti, M.P., Roy, A., Cortiella, J., Bonassar, L., and Vacanti, C.A. 成体哺乳動物における胞子様細胞の同定および初期特徴付け。J Cell Biochem 80, 455, 2001.
3. Toma, J.G., Akhavan, M., Fernandes, K.J., Barnabe-Heider, F., Sadikot, A., Kaplan, D.R., and Miller, F.D.哺乳動物の皮膚の真皮からの多能性成体幹細胞の単離。Nat Cell Biol 3, 778, 2001.
4. Kucia,M.,Reca,R.,Campbell,F.R.,Zuba-Surma,E.,Majka,M., Ratajczak, J., and Ratajczak, M.Z. 成体骨髄で同定された非常に小さな胚様(VSEL)CXCR4(+)SSEA-1(+)Oct-4 +幹細胞の集団。 Leukemia 20, 857, 2006.
5. Jiang, Y., Jahagirdar, B.N., Reinhardt, R.L., Schwartz, R.E., Keene, C.D., Ortiz-Gonzalez, X.R., Reyes, M., Lenvik, T., Lund, T., Blackstad, M., Du, J., Aldrich, S., Lisberg, A., Low, W.C., Largaespada, D.A., and Verfaillie, C.M.成体骨髄に由来する間葉系幹細胞の多能性。 Nature 418, 41, 2002. .
6. Tropepe, V., Coles, B.L., Chiasson, B.J., Horsford, D.J., Elia, A.J., McInnes, R.R., and van der Kooy, D. 成体哺乳動物の眼の網膜幹細胞。 Science 287, 2032, 2000
7. Kukekov, V.G., Laywell, E.D., Thomas, L.B., and Steindler, D.A. 成体マウス脳由来のネスチン陰性前駆細胞は、ニューロンおよびグリアを生じる。Glia 21, 399, 1997.
8. Chiasson, B.J., Tropepe, V., Morshead, C.M., and van der Kooy, D. 成体哺乳類の前脳系上衣細胞および下胸腺細胞は増殖能を示すが、上腹側細胞のみが神経幹細胞特性を有する。J Neurosci 19, 4462, 1999.
9. Brazel, C.Y., Limke, T.L., Osborne, J.K., Miura, T., Cai, J., Pevny, L., and Rao, M.S. Sox2の発現は、成体のネズミの脳におけるニューロスフェア形成細胞の異種集団を規定する。Aging Cell 4, 197, 2005.
10. Osterberg, N., and Roussa, E. マウス腹側吻側後脳から発生した初代神経スフィアの特性解析。 Cell Tissue Res 336,
11, 2009. 11. Uchida, S., Yokoo, S., Yanagi, Y., Usui, T., Yokota, C., Mimura, T., Araie, M., Yamagami, S., and Amano, S. 試験管内でのヒト角膜間質細胞によるスフィアタンパク質の形成と発現。Invest Ophthalmol Vis Sci 46, 1620, 2005.
12. Lord-Grignon, J., Abdouh, M., and Bernier, G. 成体マウスの眼の毛様体から単離された網膜前駆細胞/幹細胞コロニーで発現された遺伝子の同定。Gene Expr Patterns 6, 992, 2006.
13. Doyle, K.L., Kazda, A., Hort, Y., McKay, S.M., and Oleskevich, S. 試験管内での成体マウス嗅覚前駆細胞の有毛細胞への分化。 Stem Cells 25, 621, 2007.
14. Lehnert, L., Trost, H., Schmiegel, W., Roder, C., and Kalthoff, 中空スフィア:膵管上皮細胞の分化解析のための新しいモデル。 Ann NY Acad Sci 880, 83, 1999.
15. Kawase, Y., Yanagi, Y., Takato, T., Fujimoto, M., and Okochi, H. 皮膚からの多能性成体幹細胞の特徴:トランスフォーミング増殖因子-β(TGF-β)は、細胞増殖を促進する。Exp Cell Res 295, 194, 2004.
16. Wong, C.E., Paratore, C., Dours-Zimmermann, M.T., Rochat, A., Pietri, T., Suter, U., Zimmermann, D.R., Dufour, S., Thiery, J.P., Meijer, D., Beermann, F., Barrandon, Y., and Sommer, L. 幹細胞の特徴を有する神経堤由来の細胞は、成人の皮膚の複数の系統にさかのぼることができる。J Cell Biol 175, 1005, 2006.
17. Tamaki, T., Okada, Y., Uchiyama, Y., Tono, K., Masuda, M., Wada, M., Hoshi, A., Ishikawa, T., and Akatsuka, A. 中胚葉系および外胚葉系統間の骨格筋由来幹細胞のクローン性多分化能。Stem Cells 25, 2283, 2007.
18. Shiota, M., Heike, T., Haruyama, M., Baba, S., Tsuchiya, A., Fujino, H., Kobayashi, H., Kato, T., Umeda, K., Yoshimoto, M., and Nakahata, T. 筋原性および神経性の特性を有する骨髄由来間葉系前駆細胞の単離および特性解析。Exp Cell Res 313, 1008, 2007.
19. Hermann, A., Gastl, R., Liebau, S., Popa, M.O., Fiedler, J., Boehm, B.O., Maisel, M., Lerche, H., Schwarz, J., Brenner, R., and Storch, A. 成人ヒト骨髄間質細胞からの神経幹細胞様細胞の効率的な生成。J Cell Sci 117, 4411, 2004.
20. Hitoshi, S.[神経幹細胞の生成:胚性幹(ES)細胞からの神経幹細胞の誘導]。 Rinsho Shinkeigaku 43, 827, 2003.
21. Morikawa, S., Mabuchi, Y., Niibe, K., Suzuki, S., Nagoshi, N., Sunabori, T., Shimmura, S., Nagai, Y., Nakagawa, T., Okano, H., and Matsuzaki, Y. 間葉系幹細胞の発達は部分的に神経堤に由来する。Biochem Biophys Res Commun 379, 1114, 2009.
22. Takashima,Y.,Era,T.,Nakao,K.,Kondo,S.,Kasuga,M.,Smith, A.G., and Nishikawa, S. 神経上皮細胞は、MSC<翻訳機注:間葉系幹細胞(Mesenchymal Stem Cells:MSC)>分化の初期の一過性の変動を与える。Cell 129, 1377, 2007.
23. Reynolds, B.A., and Weiss, S.成体哺乳動物中枢神経系の単離された細胞からのニューロンおよび星状細胞の生成。 Science 255, 1707, 1992.
24. Gage, F.H. 哺乳類の神経幹細胞。 Science 287, 1433, 2000.
25. Clarke, D.L., Johansson, C.B., Wilbertz, J., Veress, B., Nilsson, E., Karlstrom, H., Lendahl, U., and Frisen, J.成体神経幹細胞の一般的能力 。 Science 288, 1660, 2000.
26. Rietze, R.L., Valcanis, H., Brooker, G.F., Thomas, T., Voss, A.K., and Bartlett, P.F. 成体マウス脳からの多能性神経幹細胞の精製。 Nature 412, 736, 2001.
27. Rogers, M.B., Hosler, B.A., and Gudas, L.J. 着床前胚、栄養芽層および精母細胞におけるレチノイン酸調節性亜鉛 - フィンガー遺伝子Rex-1の特異的発現。Development 113, 815, 1991.
28. Pelton, T.A., Sharma,S., Schulz, T.C.,Rathjen, J., and Rathjen, P.D.原始外胚葉形成中の一過性多能性細胞集団:生体内および試験管内での多能性細胞発生の相関。 J Cell Sci 115, 329, 2002.
29. Haub, O., and Goldfarb, M. マウス胚における線維芽細胞成長因子-5遺伝子の発現。 Development 112, 397, 1991.
30. Keller, G.胚性幹細胞の分化:生物学と医学における新しい時代の出現。 Genes Dev 19, 1129, 2005.
31. Takahashi, K., Mitsui, K., and Yamanaka, S. マウス胚性幹細胞における腫瘍様特性の促進におけるERasの役割。Nature 423, 541, 2003.
32. Ralston, A., and Rossant, J. マウス胚における幹細胞起源の遺伝的調節。Clin Genet 68, 106, 2005.
33. Toyooka, Y., Shimosato, D., Murakami, K., Takahashi, K., and Niwa, H.未分化ES細胞培養における亜集団の同定および特性解析。 Development 135, 909, 2008.
(原文)
Address correspondence to: Charles A. Vacanti, M.D. Laboratory for Tissue Engineering and Regenerative Medicine Department of Anesthesiology Harvard Medical School Brigham and Women’s Hospital 75 Francis St. Boston, MA 02115
E-mail: cvacanti@partners.org
Received: June 30, 2010 Accepted: September 30, 2010
Online Publication Date: December 28, 2010
(和訳)
連絡先:Charles A. Vacanti、M.D.組織工学および再生医学研究所麻酔科ハーバードメディカルスクールBrigham and Women's Hospital 75 Francis St. Boston、MA 02115
Eメール:cvacanti@partners.org
受領日:2010年6月30日受諾:2010年9月30日
オンライン出版日:2010年12月28日
(原文)
This article has been cited by:
1.Alejandro Sánchez Alvarado, Shinya Yamanaka. 2014. Rethinking Differentiation: Stem Cells, Regeneration, and Plasticity. Cell 157:1, 110-119.
2.Laure Coulombel. 2014. Après les iPS, voici les STAP, une nouvelle méthode de reprogrammation en cellules souches pluripotentes. médecine/sciences 30:2, 214-217.
3.Haruko Obokata, Teruhiko Wakayama, Yoshiki Sasai, Koji Kojima, Martin P. Vacanti, Hitoshi Niwa, Masayuki Yamato, Charles A. Vacanti. 2014. Stimulus-triggered fate conversion of somatic cells into pluripotency. Nature 505:7485, 641-647.
4.Stephen F. Badylak, Doris Taylor, Korkut Uygun. 2011. Whole-Organ Tissue Engineering: Decellularization and Recellularization of Three-Dimensional Matrix Scaffolds. Annual Review of Biomedical Engineering 13:1, 27-53.
(和訳)
この論文は以下に引用されている:
1.Alejandro Sánchez Alvarado, Shinya Yamanaka. 2014.分化を再考する:幹細胞、再生、および可塑性。 Cell 157:1, 110-119.
2.Laure Coulombel. 2014. iPSの後、多能性幹細胞の新しい再プログラミング方法であるSTAPがここにある。médecine/sciences 30:2, 214-217.
3.Haruko Obokata, Teruhiko Wakayama, Yoshiki Sasai, Koji Kojima, Martin P. Vacanti, Hitoshi Niwa, Masayuki Yamato, Charles A. Vacanti. 2014. 体細胞の多能性への刺激惹起性運命変換。Nature 505:7485, 641-647.
4.Stephen F. Badylak, Doris Taylor, Korkut Uygun. 2011. 全身組織工学:3次元マトリックススカフォールドの脱細胞化および再細胞化。Annual Review of Biomedical Engineering 13:1, 27-53.
- 2019/08/24(土) 04:51:14|
- 小保方さんの論文
-
-
| コメント:0
対訳博論概要
早稲田大学大学院先進理工学研究科
博 士 論 文 概 要
論 文 題 目
Isolation of pluripotent adult stem cells
discovered from tissues derived from all three germ layers
三胚葉由来組織に共通した
万能性体性幹細胞の探索
申 請 者
Haruko
Obokata
小保方
晴子
生命医科学専攻 環境生命科学研究
2010年 12月
体性幹細胞は、成体の体内に実際に存在し、生体の恒常性を保つため老化細胞の代替となる若い細胞を生み出し、炎症などの生体反応に応答して失われた細胞を補充する役割を担っていると考えられている。現在までに、造血幹細胞、間葉系幹細胞、神経幹細胞は多種の分化可塑性を有する体性幹細胞として研究が進められている。また、前駆細胞との区別が難しいが、各種生体組織にはそれぞれの組織幹細胞が存在していると考えられており、多くは培養系においてその存在が認められている。間葉系幹細胞研究に代表されるように、体性幹細胞の研究は発生学的な観察に基づき展開されている。哺乳類の発生において三胚葉分化は決定的な過程であり、体性幹細胞の多くも三胚葉分化の後に存在が確認されることから、三胚葉分化が起こった後は、例えば外胚葉系組織に存在している幹細胞が中胚葉や内胚葉由来組織の細胞に分化する、中胚葉系に存在している細胞が外胚葉・内胚葉由来組織の細胞に分化すると言った、いわゆる胚葉を超えた分化は起こりえないと考えられている。しかし近年、分子生物学的解析手法の発展により間葉系幹細胞の一部は外胚葉系の細胞から構成されることや、間葉系幹細胞が生体内で神経形成に関与するなどといった、いわゆる胚葉を越えた分化が三胚葉形成の後にも起こっていることが報告されている。これらの報告により、体性幹細胞の起源や分化能の限界についての大前提に疑問がもたれるようになってきている。
Vacantiらは2000年に、全身の生体の組織内には三胚葉由来によらず非常に強いストレスに耐性を有するspore-like stem cellが存在し体性幹細胞の補充に寄与している可能性を提唱してきた。その後、他の研究グループからも同様な概念に基づいた研究報告が相次いでいる。2002年には骨髄中に万能性幹細胞MAPCが存在することが報告され、2004年には間葉系幹細胞の一部に分化万能性を有するMIAMI cellが存在することが報告され、2006年には造血幹細胞の小さいサイズの分画の中にVSELS cellsが存在することが報告され、2010年には間葉系細胞の一部にストレス耐性のmuse cellsが存在することが報告されている。本研究では、spore-like stem cellの仮説を証明する第一歩として、全身の組織に共通の性質を持つ幹細胞が存在することを証明することを目標とし、幹細胞の採取、解析、再生医療研究応用への可能性を検討した。第一章では、生体組織由来のpluripotent stem cellに関する研究の動向を概説し、本研究の背景をまとめると共に、本研究の意義及び目的を明らかにした。
第二章では、spore-like stem cellの採取法を検討すると共に、幹細胞マーカーの発現を解析した。Spore-like stem cellsは細胞直径が非常に小さいという特徴を有しているため、小さい細胞を採取する方法を施行した。まず、cell sorterを用いてBlack6 マウスの骨髄細胞から、直径6μm以下の細胞のみを回収した。続いて低浸透の溶液で細胞を短時間処理することによって、大きな細胞の細胞膜を破壊し小さな細胞のみを回収した。また先端を10μmほどまで細めたガラスピペットで細胞を粉砕することによって小さい細胞を回収した。それぞれの方法で回収した細胞群を無血清培地で培養を行うと浸透圧処理または粉砕処理によって回収された細胞群から浮遊した球形のコロニー形成(以降sphereと呼ぶ)が確認された。粉砕処理を行った場合、高頻度にsphere形成が観察された。sphere形成の数は年齢依存的であり、生後4週齢のマウスからは生後8週齢のマウスの約二倍の数が観察された。Sphere形成は幹細胞の強い自己複製増殖能の結果として現れる現象であると考えられているため、免疫染色により、幹細胞マーカーの発現解析を行った。まず間葉系幹細胞や造血幹細胞など広範な体性幹細胞に発現が報告されているc-kitとSca-1の発現を調べた結果、多くのsphereに発現が確認された。続いてES細胞や発生初期の受精卵に発現が観察される万能性幹細胞マーカーであるSSEA-1とE-cadherinの発現を調べた結果、これらも多くのsphereに発現が確認されることが明らかとなった。
タンパク質レベルでの万能性幹細胞マーカーの発現が確認されたことから、遺伝子レベルでの万能性幹細胞マーカーの発現をES細胞の遺伝子発現と比較して検討を行った。特に、タンパク質レベルでのマーカーの発現強度は個々のsphereによって異なっていたため、個々のsphereは異なる遺伝子発現パターンを示すのではないかと言う予想の下、sphere一つ一つを顕微鏡下で採取し遺伝子発現の解析を行った。その結果、Oct4, Nanog, Sox2, Ecat1, Cripto, Esg1など万能性幹細胞に特異的に発現が見られる遺伝子マーカーが高頻度に発現していることが分かった。
第三章では、これらの細胞の分化能をin vitro, in vivoの双方で調査した。ES細胞から三胚葉由来の細胞へ分化させるための培養条件を参考に、培養条件を設定し分化誘導実験を行った。その結果、sphere由来の細胞は神経・筋肉・肝実質細胞などの代表的な三胚葉由来組織細胞へ分化できることが確認された。生体内での分化能と増殖能を検討するために移植実験を行った。Sphereの細胞はPGA上に播種され、2-3日PGA(poliglycolic acid)上に細胞を接着させるために培養した後、NOD/SCIDマウスの皮下に移植した。4-6週間後に移植片を採取し、組織学的、免疫組織化学的に解析を行った。移植後直径3mmほどのカプセル化した塊を形成した。内部には上皮、神経、筋肉、管といった三胚葉由来すべての組織形成が確認された。以上の結果から、粉砕処理後にsphereを形成する細胞は、無血清条件下で培養すると、非常に幼弱なタンパク質・遺伝子を発現し、培養系、生体内双方において三胚葉系由来組織への分化能を有することが示された。
第四章では同様の細胞群がその他の組織にも存在しているかを確認するため三胚葉由来組織の代表的な組織である脊髄(外胚葉)、筋肉(中胚葉)、肺(内胚葉)から細胞を単離し、粉砕処理後、無血清培養条件下で浮遊培養を行った。タンパク質マーカーの発現は骨髄で行ったときと同様にc-kit, Sca-1, SSEA-1, E-cadherin陽性の細胞が確認された。遺伝子発現解析の結果、骨髄のときと同様、ES細胞に特異的な遺伝子の発現が多数確認された。特に肺由来のsphereからは高頻度にOct4陽性のsphere細胞塊が確認された。一方、脊髄からは多くのsphere形成が確認されるが、Oct4などのES細胞特異的な遺伝子マーカーを発現したsphereの割合は骨髄由来のsphereと比較して低い値を示した。培養系での分化誘導実験を行うと、骨髄のときと同様に、各特異的なマーカーで陽性を示す三胚葉由来組織の細胞へと分化した。さらにPGAに播種しNOD/SCIDマウスの皮下に移植すると、骨髄のときと同様に上皮、神経、筋肉、軟骨、腺といった三胚葉系の組織へと分化した。以上のことから、骨髄中から発見された広範な分化能を有する細胞群は、脊髄、筋肉、肺といったすべての三胚葉由来組織からも単離され得ることが確認された。
第五章では、幹細胞の万能性を証明するための最も重要な証明方法であるキメラマウスの作成を幼弱神経幹細胞培養条件であるbFGF, LIF依存浮遊培養系によって培養したsphereを用いて試みた。ICRマウスの受精卵とsphereを用いた凝集法によってキメラ卵を作成し、24時間培養した後、子宮に移植した。20日後に産まれた新生児の毛皮にはsphere由来の毛が観察されなかった。また産まれてきた新生児の数は移植した受精卵の数よりも少なかった。キメラの胎生致死、もしくは特定の組織への貢献、もしくは低頻度での貢献の可能性が考えられたため、胎生12.5日目の胎児の解析を行った。その結果全身にsphere由来の細胞が散在していることが確認された。このことから、sphere由来の細胞は全身の組織形成に寄与できる能力を有していることが明らかとなった。
第六章では本研究の総括と展望について述べた。本研究ではこれまでの常識を超えた体性幹細胞の起源と分化可能性についての新しい学説をもとに、体性幹細胞の創生の可能性を探る実験を試みた。本研究で得られた幹細胞が実際に生体内に存在するかどうかは、これから明確にすべき大きな課題である。しかしながら培養法をさらに効率化することによって大量培養を可能とし、組織工学をはじめとする再生医療研究の新たな細胞ソースとして期待できる。また、これまでiPS細胞を始めとした万能性幹細胞の創生の研究が盛んに行われているが、再生医療研究に必要なのは安全に機能する体性幹細胞であり、万能性幹細胞からの体性幹細胞の分化誘導は難しい。そこで本研究の第四章で検討したような体性幹細胞を体細胞から創出する試みが成功すれば細胞生物学的にも発生学的にも非常にインパクトのある研究成果となり、再生医療応用に最も適した細胞ソースを提供できるようになるものと期待される。
早稲田大学 博士(工学) 学位申請 研究業績書
氏 名 小保方 晴子 印
(2010年 11月 現在)
種 類 別
題名、 発表・発行掲載誌名、 発表・発行年月、 連名者(申請者含む)
(原文)
報文
(1) Haruko Obokata, Masayuki Yamato, Kohji Nishida, Satoshi Tsuneda, and Teruo Okano, "Subcutaneous transplantation of autologous oral mucosal epithelial cell sheets fabricated on temperature-responsive culture dishes", Journal of Biomedical Materials Research: A 86:1088-96. 2007
〇(2) Haruko Obokata, Koji Kojima, Masayuki Yamato, Satoshi Tsuneda, Charles A. Vacanti, “The potential of stem cells in adult tissues representative of the three germ layers.”,Tissue Eng Part A. 2010 in press.
(3) Haruko Obokata, Masayuki Yamato, Kohji Nishida, Satoshi Tsuneda, and Teruo Okano,“Time-course アnalyses of reconstructed ultrastructure change in oral mucosal epithelium cell sheet after subcutaneous transplantation” submitted to Journal of Tissue Engineering and Regenerative Medicine.
(4) Haruko Obokata, Masayuki Yamato, Satoshi Tsuneda, and Teruo Okano, “Protocol for reproducible subcutaneous transplantation of cell sheets” submitted to Nature Protocols.
(5) Haruko Obokata, Masayuki Yamato, Satoshi Tsuneda, and Teruo Okano, “The effectiveness of inflammatory cytokines for regeneration of transplanted cultured keratinocyte cells” submitted to Journal of Investigative Dermatology
(6) Haruko Obokata, Masayuki Yamato, Satoshi Tsuneda, and Teruo Okano, “Hyperacute inflammation アnalyses after subcutaneous transplantation of human fibroblast cell sheets into Lewis rats.”submitted to Xenotransplantation.
(和訳)
報文
(1) Haruko Obokata, Masayuki Yamato, Kohji Nishida, Satoshi Tsuneda, and Teruo Okano, 「温度応答性培養皿上で作製された自己口腔粘膜上皮細胞シートの皮下移植」, Journal of Biomedical Materials Research: A 86:1088-96. 2007
〇(2) Haruko Obokata, Koji Kojima, Masayuki Yamato, Satoshi Tsuneda, Charles A. Vacanti, 「三胚葉各成体組織内在幹細胞の潜在能力」,Tissue Eng Part A. 2010 in press.
(3) Haruko Obokata, Masayuki Yamato, Kohji Nishida, Satoshi Tsuneda, and Teruo Okano,「皮下移植後の口腔粘膜上皮細胞シートにおける再構築された超構造変化の時間経過分析」submitted to Journal of Tissue Engineering and Regenerative Medicine.
(4) Haruko Obokata, Masayuki Yamato, Satoshi Tsuneda, and Teruo Okano, 「細胞シートの再現性ある皮下移植のためのプロトコール」submitted to Nature Protocols.
(5) Haruko Obokata, Masayuki Yamato, Satoshi Tsuneda, and Teruo Okano, 「移植された培養ケラチノサイト細胞再生のための炎症性サイトカインの有効性」submitted to Journal of Investigative Dermatology
(6) Haruko Obokata, Masayuki Yamato, Satoshi Tsuneda, and Teruo Okano, 「ヒト線維芽細胞シートをルイスラットに皮下移植した後の超急性炎症の解析」submitted to Xenotransplantation.
(原文)
講演(海外)
(1) Haruko Obokata, Masayuki Yamato, Kohji Nishida, Satoshi Tsuneda, and Teruo Okano, "Subcutaneous transplantation of autologous oral mucosal epithelial cell sheets fabricated on temperature-responsive culture dishes", Society for Biomaterials 2007 Annual Meeting, Chicago, IL, April 17-21, 2007.
(2) Haruko Obokata, Masayuki Yamato, Kohji Nishida, Satoshi Tsuneda, and Teruo Okano, "Time-course observation of subcutaneous transplanted autologous oral mucosal epithelial cell sheets fabricated on temperature-responsive culture dishes",, The 13th World Congress of International Society for Artificial Organs, IFAO-JSAO Annual Meeting, Osaka, Japan, Jun 28-31, 2007
(3) Haruko Obokata, Masayuki Yamato, Kohji Nishida, Satoshi Tsuneda, and Teruo Okano, "Inflammatory アnalyses of subcutaneously-transplanted human epithelial cell sheets", Termis-AP, Tokyo, Japan, December 3-5, 2007
(4) Koji Kojima, Shohta Kodama, Haruko Obokata, Ana C Paz, Charles A. Vacanti. “Generation of Pneumospheres from Pulmonary Stem Cells.” Termis-NA, San Diego, December 7-10, 2008,
(5) Haruko Obokata, Masayuki Yamato, Kohji Nishida, Satoshi Tsuneda, and Teruo Okano, “Subcutaneous Transplantation of Oral Mucosal Epithelial Cell Sheets Fabricated on Temperature-Responsive Culture Dishes”, TERMIS-WC, Seoul, Korea, August 31- September 3, 2009
(6) Haruko Obokata, Masayuki Yamato, Kohji Nishida, Satoshi Tsuneda, and Teruo Okano, “Inflammation アnalyses after Subcutaneous Transplantation of Cell Sheets for a Novel Tissue Engineering Method”, TERMIS-WC, Seoul, Korea, August 31- September 3, 2009
(7) Koji Kojima, Haruko Obokata, Ana C Paz and Charles A. Vacanti. “Generation of Pneumospheres from Pulmonary Stem Cells.” TERMIS-WC, Seoul, Korea, August 31- September 3,2009
(8) Haruko Obokata, Koji Kojima, Masayuki Yamato, Teruhiko Wakayama, Teruo Okano, Satoshi Tsuneda and Charles A. Vacanti, “The potential of stem cells in adult tissues representative of the three germ layers.”TERMIS-NA, Orlando, December 5-9 2010
(9) Koji Kojima, Haruko Obokata, Jason Ross and Charles A. Vacanti. “Autologous Tissue Engineered Trachea with Epithelial Cell Sheets in Ovine Model.” TERMIS-NA, Orlando, December 5-9 2010
(和訳)
講演(海外)
(1) Haruko Obokata, Masayuki Yamato, Kohji Nishida, Satoshi Tsuneda, and Teruo Okano, 「温度応答性培養皿上で作製された自己口腔粘膜上皮細胞シートの皮下移植」, Society for Biomaterials 2007 Annual Meeting, Chicago, IL, April 17-21, 2007.
(2) Haruko Obokata, Masayuki Yamato, Kohji Nishida, Satoshi Tsuneda, and Teruo Okano, 「皮下移植後の口腔粘膜上皮細胞シートにおける再構築された超構造変化の時間経過分析」,, The 13th World Congress of International Society for Artificial Organs, IFAO-JSAO Annual Meeting, Osaka, Japan, Jun 28-31, 2007
(3) Haruko Obokata, Masayuki Yamato, Kohji Nishida, Satoshi Tsuneda, and Teruo Okano, 「皮下移植されたヒト上皮細胞シートの炎症分析」, Termis-AP, Tokyo, Japan, December 3-5, 2007
(4) Koji Kojima, Shohta Kodama, Haruko Obokata, Ana C Paz, Charles A. Vacanti. 「肺幹細胞からの肺炎球の生成」Termis-NA, San Diego, December 7-10, 2008,
(5) Haruko Obokata, Masayuki Yamato, Kohji Nishida, Satoshi Tsuneda, and Teruo Okano,「温度応答性培養皿上で作製された口腔粘膜上皮細胞シートの皮下移植」, TERMIS-WC, Seoul, Korea, August 31- September 3, 2009
(6) Haruko Obokata, Masayuki Yamato, Kohji Nishida, Satoshi Tsuneda, and Teruo Okano, 「新しい組織工学的方法のための細胞シートの皮下移植後の炎症分析」, TERMIS-WC, Seoul, Korea, August 31- September 3, 2009
(7) Koji Kojima, Haruko Obokata, Ana C Paz and Charles A. Vacanti. 「肺幹細胞からの肺炎球の生成」TERMIS-WC, Seoul, Korea, August 31- September 3,2009
(8) Haruko Obokata, Koji Kojima, Masayuki Yamato, Teruhiko Wakayama, Teruo Okano, Satoshi Tsuneda and Charles A. Vacanti, 「三胚葉各成体組織内在幹細胞の潜在能力」TERMIS-NA, Orlando, December 5-9 2010
(9) Koji Kojima, Haruko Obokata, Jason Ross and Charles A. Vacanti. 「羊皮症モデルにおける上皮細胞シートを伴う自己組織化工気管」TERMIS-NA, Orlando, December 5-9 2010
講演(国内)
(10) 小保方晴子、大和雅之、西田幸二、常田聡、岡野光夫、「温度応答性培養皿で作製した口腔粘膜上皮細胞シートの皮下移植」、第6回日本再生医療学会総会、横浜、2007年3月14日
(11) 小保方晴子、大和雅之、西田幸二、常田聡、岡野光夫、「温度応答性培養皿で作製した口腔粘膜上皮細胞シートの皮下移植」、第7回日本再生医療学会総会、名古屋、2008年3月14日
(12) 小保方晴子、大和雅之、西田幸二、常田聡、岡野光夫、「細胞シート皮下移植後の急性期炎症反応解析」、第29回炎症・再生学会、東京、2008年7月8日-10日
(13) 小保方晴子、大和雅之、西田幸二、常田聡、岡野光夫、「ヒト上皮細胞シート皮下移植後の経時的炎症反応解析」、第9回日本再生医療学会総会、広島、2010年3月17日
(14) 小保方晴子、小島宏司、大和雅之、若山照彦、常田聡、岡野光夫、Charles A. Vacanti,「三胚葉由来組織に共通した成体幹細胞の探索」第10回日本再生医療学会総会、東京、2011年3月1日-2日
国際特許
Haruko Obokata, Charles A. Vacanti.
Sub Population of Retained Embryonic Like Cells
(成体の中に存在する幼弱な表現系を有し、3胚葉系の細胞に分化することのできる幹細胞集団)
著書・著作物
大和雅之、小保方晴子 「成長因子」バイオマテリアルの基礎、日本バイオマテリアル学会、印刷中
- 2019/08/24(土) 22:49:55|
- 小保方さんの論文
-
-
| コメント:0
対訳博論目次
(原文)
Contents
1. Background
1.1 General Introduction - 1
• Importance of stem cells
• Unique properties of all stem cells
1.2 Adult stem cell - 7
• History of Adult stem cell research
• Function of adult stem cells
1.3 Research methods for identifying adult stem cells - 10
• Normal differentiation pathways of adult stem cells.
• Transdifferentiation.
1.4 Pluripotent stem cells - 14
• The similarities and differences between embryonic and adult stem cells
• Embryonic stem cells
A. Establish<→Estalishment> of embryonic stem cells grown in the laboratory
B. Tests for identifying embryonic stem cells
• Induced pluripotent stem cells
1.5 Possibility of existence of adult pluripotent stem cells - 20
• Spore-like stem cells
1.6 Hypothesis of this research - 23
2. Isolation of small cells
2.1 Introduction - 27
2.1.1 Stem cells and small cells - 27
2.1.2 Stem cells and sphere formation - 27
2.2 Experimental<→Experiment> -28
2.2.1 Isolation of small cells - 28
2.2.2 Characterization of small cells - 29
2.3 Results - 30
2.3.1 Sphere forming from isolated cells - 30
2.3.2 Effect of trituration - 30
2.3.3 Culture conditions of small cells - 31
2.3.4 Sphere formation from bone marrow cells - 31
2.3.5 Immature cell marker expression - 32
2.3.6 Expression of embryonic like phenotypes - 33
2.3.7 Quantitative PCR of Pluripotent markers - 34
2.4 Summary of section 2 - 35
2.5 Discussion - 35
2.6 References - 45
3. Characterization of small cells
3.1 Introduction - 48
3.1.1 Differentiation potential of stem cells
3.2 Experimental<→Experiment> - 48
3.2.1 Differentiation potential of cells in vitro - 48
3.2.2 Differentiation potential in vivo - 48
3.3 Results - 49
3.3.1 Differentiation potential of cells in vitro -50
3.3.2 Differentiation potential of cells in vivo - 51
3.4 Summary of section 3 - 51
3.5 Discussion - 51
3.6 Referances - 58
4. Isolation of small cells from TISSUES DERIVED FROM ALL THREE GERM LAYERS
4.1 Introduction - 63
4.2 Experimental<→Experiment> - 63
4.2.1 Isolation of small cells from various tissues - 64
4.2.2 Characterization of isolated small cells - 64
4.2.3 Differentiation potential of sphere forming small cells - 64
4.3 Results - 65
4.3.1 Sphere formation from tissues derived from representative of the three germ layers - 65
4.3.2 Immature gene expression of spheres derived from tissues representative of the three germ layers -66
4.3.3 Differentiation potential of Cells derived from tissues representative of the three germ layers-67
4.3.4 Differentiation potential of cells in vivo - 68
4.4 Summary of section 4 - 69
4.5 Discussion - 69
4.6 References - 76
5. Chimera mice generation from ISOLATED SMALL CELLS
5.1 Introduction - 81
5.1.1 Adult stem cells and chimera mice - 81
5.2 Experimental<→Experiment> - 81
5.2.1 Chimera mice generation with spheres - 82
A. Aggregation method
B. Injection method
5.2.2 Genotyping - 82
5.2.3 Immunohistological analyses - 82
5.3 Results - 83
5.3.1 Generation of chimera zygotes - 83
5.3.2 アnalyses of adult chimera mice - 83
5.3.3 アnalyses of chimera fetuses - 83
5.4 Summary of section 5 - 84
5.5 Discussion - 85
5.6 References - 93
6. Future prospects
6.1 General overview - 95
6.2 Cell source for tissue engineering regenerative medicine - 95
6.3 Future issues - 96
APPENDIX - 97
• Material and method
• Primer sequences
ACKNOWLEDGEMENTS
CURRICULUM VITAE
(和訳)
目次
1.背景
1.1概論 - 1
•細胞の重要性
•すべての幹細胞のユニークな特性
1.2成体幹細胞 - 7
•成体幹細胞研究の歴史
・成体幹細胞の機能
1.3成体幹細胞を同定するための研究方法 - 10
•成体幹細胞の正常な分化経路
•分化転換。
1.4多能性幹細胞 - 14
•胚性および成体幹細胞の類似点と相違点
•胚性幹細胞
A.実験室で増殖した胚性幹細胞の樹立
B.胚性幹細胞の同定試験
・誘導性多能性幹細胞
1.5多能性成体幹細胞存在の可能性 - 20
•胞子様幹細胞
1.6この研究の仮説 - 23
2.小細胞の単離
2.1序論 - 27
2.1.1幹細胞と小細胞 - 27
2.1.2幹細胞と球体形成 - 27
2.2実験 - 28
2.2.1小細胞の分離 - 28
2.2.2小細胞の特性 - 29
2.3結果 - 30
2.3.1単離細胞からの球体形成 - 30
2.3.2トリチュレーション効果 - 30
2.3.3小細胞の培養条件 - 31
2.3.4骨髄細胞からの球体形成 - 31
2.3.5未熟細胞マーカー発現 - 32
2.3.6胚的表現型の発現 - 33
2.3.7多能性マーカーの定量PCR - 34
2.4第二章のまとめ - 35
2.5討論 - 35
2.6参考文献 - 45
3.小細胞の特性
3.1序論 - 48
3.1.1幹細胞の分化能
3.2実験 - 48
3.2.1試験管内での細胞の分化能 - 48
3.2.2生体内での分化能 - 48
3.3結果 - 49
3.3.1試験管内での細胞の分化能 - 50
3.3.2生体内での細胞の分化能 - 51
3.4第三章のまとめ - 51
3.5討論 - 51
3.6参照 - 58
4.全三胚葉由来組織からの小細胞の単離
4.1序論 - 63
4.2実験 - 63
4.2.1様々な組織からの小細胞の分離 - 64
4.2.2分離された小細胞の特性 - 64
4.2.3球体を形成する小細胞の分化能 - 64
4.3結果 - 65
4.3.1三胚葉代表由来組織からの球体形成 - 65
4.3.2三胚葉代表組織由来球体の未熟遺伝子発現 - 66
4.3.3三胚葉代表組織由来細胞の分化能 - 67
4.3.4生体内における細胞の分化能 - 68
4.4第四章のまとめ - 69
4.5討論 - 69
4.6参考文献 - 76
5.分離小細胞からのキメラマウス作製
5.1序論 - 81
5.1.1成体幹細胞とキメラマウス - 81
5.2実験 - 81
5.2.1球体によるキメラマウス作製 - 82
A.凝集法
B.注入法
5.2.2遺伝子型決定 - 82
5.2.3免疫組織学分析 - 82
5.3結果 - 83
5.3.1キメラ接合体の作製 - 83
5.3.2成長キメラマウスの分析 - 83
5.3.3キメラ胎児の分析-83
5.4第五章のまとめ - 84
5.5討論 - 85
5.6参考文献 - 93
今後の展望
6.1概観 - 95
6.2組織工学的再生医療用の細胞供給源 - 95
6.3今後の課題 - 96
付録 - 97
•材料と方法
•プライマー配列
謝辞
履歴書
- 2019/08/24(土) 22:51:47|
- 小保方さんの論文
-
-
| コメント:0
博論第2章
草稿目次との対比
(11jigen引用箇所)
2.小細胞の単離
2.1序論 - 27
2.1.1幹細胞と小細胞 - 27
2.1.2幹細胞と球体形成 - 27
2.2実験 - 28
2.2.1小細胞の分離 - 28
2.2.2小細胞の特性 - 29
2.3結果 - 30
(11jigen非引用個所)
2.3.1単離細胞からの球体形成 - 30
2.3.2トリチュレーション効果 - 30
2.3.3小細胞の培養条件 - 31
2.3.4骨髄細胞からの球体形成 - 31
2.3.5未熟細胞マーカー発現 - 32
2.3.6胚的表現型の発現 - 33
2.3.7多能性マーカーの定量PCR - 34
2.4第二章のまとめ - 35
2.5討論 - 35
2.6参考文献 - 45
(原文)
2. ISOLATION OF SMALL CELLS
2.1 Introduction
2.1.1 Stem cells and small cells
Generally speaking, stem cells are small. The ratio of cytoplasm and nuclear is one of remarkable indexes of stem cells. However, the isolation method of only small cells is yet established.
(和訳)
2. 小細胞の単離
2.1 序論
2.1.1 幹細胞と小細胞
一般的に言えば、幹細胞は小さい。細胞質と核の割合は幹細胞の顕著な指標の一つである。しかし、小細胞だけの単離方法はもう確立されている。
(原文)
2.1.2 Stem cells and sphere formation
Sphere formation is recognized as one of the results of stem cell property since stem cell is recognized that they have strong proliferative potential and self-renewal potency. Recently, many reports demonstrated that various adult tissues contained sphere forming cells. Cells derived from many adult tissues, including retina, brain, cornea, olfactory neuroepithelium, pancreas, skin, muscle and bone marrow have been propagated as non-adherent clusters or spheres, as have embryonic stem cells.
Cells contained within the spheres described in those reports, exhibit neural lineage markers and appear to possess varying degrees of stem cell potency. We believe that adult stem cells described in various reports represent the same adult stem cells at different stages of development, expressing different degrees of potency. Sphere forming cells are much more immature than previously expected. We hypothesized that adult stem cells procured from any tissue, endoderm, mesoderm or ectoderm, could demonstrate a wide multipotency and cross germ layers when maintained in appropriate environments. Therefore, we first investigated how to isolate small cells. And then we examined if they had sphere forming potency in the serum-free condition.
(和訳)
2.1.2 幹細胞と球体形成
幹細胞が強い増殖能力および自己再生能力を持っていることが認識されて以来、スフィア形成は幹細胞特性の結果の一つとして認識されている。最近では多くの報告が、様々な成体組織がスフィア形成細胞を含むことを示している。網膜、脳、角膜、嗅覚神経上皮、膵臓、皮膚、筋肉および骨髄を含む多くの成人組織に由来する細胞が、胚性幹(ES)細胞がそうであるように、非付着性のクラスタ又はスフィアとして増殖されてきた。
これらのレポートに記載されているスフィアに含まれる細胞は神経系統マーカーを発現し、幹細胞能力の様々な程度を保有するように見える。我々は様々な報告書に記載された成体幹細胞は発達の異なる段階での効力の異なる程度を表現する同一の成体幹細胞を表すと考えている。スフィア形成細胞は前もって予想されていたよりもはるかに未成熟である。我々は内胚葉、中胚葉または外胚葉からのどんな組織から獲得された成体幹細胞でも、適切な環境下で維持するとき、広い多能性を示し、胚葉を横断することができるという仮説を立てた。そこで我々はまず小細胞を単離する方法を検討した。そして次に無血清状態でスフィア形成能があるかどうか調べた。
(原文)
2.2 Experimentall<→Experiment>
2.2.1 Isolation of small cells
Bone marrow, lung, muscle and spinal cord tissues were procured from 3- to 4-week-old C57BL/6J mice as described below. Bone marrow was acquired by flushing femur and tibia with culture media using an insulin syringe. Cells were plated at 1x10^ cells/cm" in F12/DMEM (1:1, v/v) supplemented with 2% B27, 20ng/ml bFGF and lOng/ml EGF
To isolate small cells from murin bone marrow, the following three types of methods were examined.
(和訳)
2.2 実験
2.2.1 小細胞の分離
以下に述べているように骨髄、肺、筋肉および脊髄組織は3~4週齢のC57BL / 6Jマウスから入手した。骨髄はインスリン注射器を用いて培養液で大腿骨と脛骨を洗い出すことによって取得した。細胞は1×10^細胞/ cmで、2%B27、20ng/ mlのbFGF及び10ng/ mlのEGFを補充したF12/ DMEM(1:1、v / v)に播種した。
げっ歯類骨髄の小細胞を単離するために、以下の3種類の方法が試された。(訳注:murin bone marrowは難波氏が噛みついてmiceという言葉も知らないのかと疑義されたが、無論murinはmiceより広い概念だというだけで間違いではない。キンガ論文にも使われている言葉。小保方さんは細胞シートの研究でよくこの言葉を使っていたので、こう書いて置いたかもしれない。何しろ何よりもこれは草稿であった。)
(原文)
A. Cell sorter
Forward scatter was calibrated by size-defined beads. Less than 8 micro meters in diameter cells were isolated.
B. Optimistic<→Osmotic> pressure
Bone marrow cells were exposed to low optimistic<→osmotic> pressure liquid to destroy mature cells.
C. Trituration using thin-glass pipette
Standard glass pipettes were burned and stretched out to make thin tips. Mature cells were passed through thin glass pipettes many times and destroyed by mechanical stress. Obtained small cells were cultured in serum free medium, and appeared spheres were counted as a number of stem cells.
(和訳)
A. 細胞ソーター
前方散乱はサイズ定義されたビーズにより調整された。直径8マイクロメートル未満の細胞が単離された。
B. 浸透圧<訳注:これも難波氏の噛みついたところ。単なる勘違いでお疲れというだけの話。無論osmoticの間違い。論文審査で直されるのでこれが草稿だという何よりの証拠の一つでもある。>
骨髄細胞は成熟細胞を破壊するために低浸透圧液体に曝された。
C. 細ガラスピペットを使用しての粉砕
標準ガラスピペットは細い先端を作るために焼かれて伸ばされた。成体細胞は細ガラスピペットを何度も通され機械的ストレスによって破壊された。得られた小細胞は、無血清培地で培養し、スフィアが幹細胞の数としてカウントされた。
(原文)
2.2.2 Characterization of small cells
Immunohistochemistry. Protein expression was assessed using immunohistochemical techniques as described below. Each slide was incubated with anti-c-kit rat monoclonal antibody, anti-Sca-1 rat monoclonal antibody or anti-E-cadherin rat monoclonal antibody. After washing with PBS, the cells were incubated with goat anti-rat IgG Texas Red-conjugated antibodies and goat anti-rat IgG Fluorescein-conjugated antibodies. SSEA-1 and Alkaline phosphatase (AP) staining was performed using the ES cell detection Kit
Single sphere RT-PCR. Single spheres were individually collected under the microscope. Total RNA was extracted from each single sphere, and then subjected to oligo-dT-primed reverse transcription (RT). RT-PCR was performed using TaqDNA polymerase on an iCycler for 35 cycles.
(和訳)
2.2.2 小細胞の特性
免疫組織化学。タンパク質発現は下記に記された免疫組織化学法を用いて評価された。各ガラススライドはanti-c-kit rat monoclonal 抗体, anti-Sca-1 rat monoclonal 抗体または、 anti-E-cadherin rat monoclonal 抗体によって培養された。 PBSで洗浄後、細胞は goat anti-rat IgG Texas Red-conjugated 抗体と goat anti-rat IgG Fluorescein-conjugated 抗体で培養された。ES細胞検出キットを用いてSSEA-1およびアルカリホスファターゼ(AP)染色が行なわれた。<訳注:ピリオドが無い。ここも草稿である証拠の一つ。そもそも小保方さんはかなり粗忽な性格で、ケアレスミスはとても多い。博論の草稿を印刷するというのはいくら多忙でも粗忽すぎる。文章も切り貼りして校正するときに動詞が抜けたりする。>
単体スフィアの逆転写ポリメラーゼ連鎖反応。単体スフィアが個別に顕微鏡下に集められた。全RNAが各単体スフィアから抽出され、次にオリゴdTプライミング逆転写(RT)が行なわれた。 RT-PCRはiCycler上のTaqDNAポリメラーゼを用いて35サイクル行われた。
(原文)
2.3 Results
2.3.1 Sphere forming from isolated cells
Trituration and optimistic<→osmotic> pressure produced spheres. Whereas, cell sorter did not produced any spheres. Trituration produced most number of spheres. Therefore, we utilized trituration as the isolation method of small cells.
(和訳)
2.3 結果
2.3.1単離された細胞からのスフィア形成
粉砕と浸透圧<ここでも続けてoptimisticとosmoticの取り違えがあるがoptimisticというのは楽観的という意味で誰でも知っている。こんな言葉とosmoticを取り違えたまま気づかないでいるということを疲れてるなと思わない人は悪意なだけの人。金をもらって悪口を書いている。>がスフィアを作った。一方、セルソーターはスフィアを作らなかった。<訳注:Whereasは副詞的に使用しているようだが前文とカンマとの関係がおかしい。草稿ということもあってこのような文章になっている。普通こういうところを読むと草稿だと気付くものだが難波氏や11jigenは悪意を持って読んでいるから気づかない。> 粉砕が最も多くスフィアを生産した。我々は粉砕法を小細胞の単離方法として採用した。
(原文)
2.3.2 Effect of trituration
After the trituration, the population of small cells was increased comparing to native bone marrow cells (Fig. 3A and B). However not all of cells over 8 micro meters in diameter disappeared. Triturated cells formed spheres during culture.Interestingly, spheres were consisted of only small cells (Fig. 3C). Thus, it was demonstrated that trituration enabled to culture and grow only small cells.
(和訳)
2.3.2 トリチュレーション効果
粉砕後、小細胞の集団は元の骨髄細胞と比較して増加した(図3AおよびB)。 しかし、直径8ミクロンを超える細胞のすべてが消失したわけではない。粉砕された細胞は培養中にスフィアを形成した。興味深いことに、球体は小さな細胞のみで構成されていた(図3C)。 したがって、粉砕は小細胞のみを培養増殖させ得たことが実証された。
- 2019/08/24(土) 22:53:49|
- 小保方さんの論文
-
-
| コメント:0
博論第3章
草稿目次との対比
(11jigen引用箇所)
3.小細胞の特性
3.1序論 - 48
3.1.1幹細胞の分化能
3.2実験 - 48
3.2.1試験管内での細胞の分化能 - 48
3.2.2生体内での分化能 - 48
3.3結果 - 49
3.3.1試験管内での細胞の分化能 - 50
3.3.2生体内での細胞の分化能 - 51
3.4第三章のまとめ - 51
3.5討論 - 51
3.6参照 - 58
(原文)
3. DIFFERENTIATION POTENTIAL OF SMALL CELLS
3.1 Introduction
3.1.1 Differentiation potential of stem cells
One of definitions of stem cells is multidifferentiation potential. Also the degree of their stemness is determined by their differentiation potential. According to results of section 2, sphere forming cells expressed pluripotent cell markers. Therefore in this section, we aimed to confirm their differentiation potential in vivo and in vitro.
(和訳)
3. 小細胞の分化能<訳注:目次では3. Characterization of small cellsとなっているので、小保方さんがいろいろと編集中であることがわかる。これを見て草稿だと気づけない頭というのもどうなのか。>
3.1 序論
3.1.1 幹細胞の分化能
幹細胞の定義の一つは多分化能である。それらの幹細胞性の程度もまたそれらの分化能によって決定される。第2章の結果によると、球体形成細胞は多能性細胞マーカーを発現した。したがってこの章では、我々は生体内および試験管内での分化能を確認することを目的とした。
(原文)
3.2 Experimental<→Experiment>
3.2.1 In vitro Differentiation Assays.
In vitro differentiation assays were examined following the published differentiation culture conditions for murin ES cells.
Mesoderm lineage differentiation assay. Dissociated muscle cells were stained with anti-αmooth muscle actin antibody, anti-Myosin antibody and anti-Desmin antibody. Chondrocyte were stained with Safranin-0 and Fast Green. Osteocytes were stained with ALIZARIN RED S. After 21 days, adipocytes were stained with Oil Re 0.
Ectoderm lineage (Neural lineage) differentiation assay. Cells were plated on ortinin-coated chamber slides and incubated with anti-βIII Tubuin mouse monoclonal, anti-O4 mouse monoclonal antibody and anti-GFAP mouse monoclonal antibody.
Endoderm lineage (Hepatic) differentiation assay. Differentiated cells were detected by immunohistochemistory using anti-αfetoprotein mouse monoclonal antibody, anti-Albumin goat polyclonal antibody and anti-Cytokeratin 18 mouse monoclonal antibody. Results from immunohistochemistry were confirmed by RT-PCR.
(和訳)
3.2 実験
3.2.1 試験管内分化実験<訳注:目次では3.2.1 Differentiation potential of cells in vitroとなっているので、小保方さんがいろいろと編集中であることがわかる。これを見て草稿だと気づけない頭というのもどうなのか。>
試験管内分化検証は次の公表されているげっ歯類ES細胞用分化培養条件で調べられた。
中胚葉系統分化検査。解離された筋細胞は anti-αmooth muscle actin 抗体、anti-Myosin 抗体 及び anti-Desmin 抗体で染色された。軟骨細胞はSafranin-0および Fast Greenで染色された。骨細胞はALIZARIN RED Sで染色された。21日後に脂肪細胞をOil Re 0で染色した。
外胚葉系統(神経系統)分化検査。細胞はortininコーティングされたチャンバースライド上に播種され、anti-βIII Tubuin mouse monoclonal、anti-O4 mouse monoclonal antibody及びanti-GFAP mouse monoclonal antibodyで培養された。
内胚葉系統(肝)分化検査。分化した細胞はanti-αfetoprotein mouse monoclonal antibody、anti-Albumin goat polyclonal antibody及びanti-Cytokeratin 18 mouse monoclonal antibodyを使った免疫組織化学によって検出された。免疫組織化学の結果はRT-PCRによって確認された。
(原文)
3.2.2 In Vivo Differentiation.
Spheres were seeded onto biodegradable scaffolds and implanted into subcutaneous of NOD/SCID mice (Charles River laboratories). After 6 weeks, the implants were harvested and fixed with 10% formaldehyde, then examined by immunocytochemistry.
(和訳)
3.2.2 生体内分化<訳注:目次では3.2.2 Differentiation potential in vivoとなっているので、小保方さんがいろいろと編集中であることがわかる。これを見て草稿だと気づけない頭というのもどうなのか。>
スフィアは生分解性培地上に播種し、NOD / SCIDマウス<訳注:超免疫不全マウス> (Charles River laboratories社)の皮下に移植した。 6週間後、移植片を採取し、10%ホルムアルデヒドで固定した後に免疫細胞化学によって調べられた。
(原文)
3.3Results
3.3.1 Differentiation potential of cells in vitro
When representative bone marrow derived spheres were dissociated into single cells and exposed to three different differentiation media, the cells differentiated to express specific genes of the three lineages, Map2 (ectoderm), MyoD (mesoderm) and alpha-fetoprotein (AFP, endoderm) (Fig. 10).The addition of a neural differentiation medium to the in vitro environment of cells from bone marrow spheres, resulted in expression of pIII tubulin (a marker for neuron) (Fig. 11).
Alternatively, the addition of 20% fetal calf serum to the media resulted in the expression of markers representative of mesoderm; that is, a-smooth muscle actin (Fig. 11) as well as the mesenchymal cells, chondrocytes, osteocytes and adipocytes (Fig. 12). Thus, cells from spheres differentiated into all cell types of neural (neurons, oligodendrocytes and ghas) and mesenchymal stem cell lineage (chondrocytes, osteocytes and adipocytes). When exposed to a hepatocyte differentiation media the expression of a-fetoprotein (Fig. 11), was seen, suggestive of differentiation into endodermal tissue.
(和訳)
3.3 結果
3.3.1 試験管内での細胞の分化能
代表的な骨髄由来のスフィアを単一細胞に解離し、三つの異なる分化培地に移植したとき、細胞は、Map2(外胚葉)、MyoD(中胚葉)及びα-フェトプロテイン(AFP、内胚葉)の三系統の特定の遺伝子を発現して分化した(図10)。骨髄スフィアからの細胞の試験管内環境への神経分化溶剤の添加は、pIIIのチューブリン(ニューロンのマーカー)の発現をもたらした(図11)。
代わりに、媒体に20%のウシ胎児血清を添加すると、中胚葉を代表するマーカーの発現を生じた。即ち平滑筋アクチン(図11)更には間葉系細胞、軟骨細胞、骨細胞及び脂肪細胞である(図12)。このように、スフィアからの細胞は神経(ニューロン、オリゴデンドロサイトおよび膠細胞)と間葉系幹細胞系譜(軟骨細胞、骨細胞及び脂肪細胞)の全ての細胞型に分化した。肝細胞分化培地にさらすと、内胚葉組織への分化を示唆するaフェトプロテインの発現(図11)が見られた。
(原文)
3.3.2 Differentiation potential in vivo.
Bone marrow spheres and ES cells were transplanted subcutaneously into immune deficient mice to examine their tumor-initiating capacity. As a result, after 6 weeks ES cells formed a tumor. Spheres did not form tumor as big as ES cells did. We concluded that the proliferative potential of sphere cells was much weaker than that of ES cells (Fig. 13).
Next, we investigated if transplanted cells differentiated in vivo after transplantation. Transplanted cells were harvested after 6 weeks, and processed for immunohistochemical analyses. According to results of immunohistochemical analyses, spheres differentiated into tissues derived from three germ layers in vivo (Fig. 14).
(和訳)
3.3.2 生体内分化能<訳注:目次では3.3.2 Differentiation potential of cells in vivoとなっているので、小保方さんがいろいろと編集中であることがわかる。これを見て草稿だと気づけない頭というのもどうなのか。>
骨髄のスフィア及びES細胞が、それらの腫瘍形成能力を調べるために、免疫欠損マウスに皮下移植された。その結果、6週間後にES細胞は腫瘍を形成した。我々はスフィア細胞の増殖能がES細胞よりもはるかに弱かったと結論付けた(図13)。
次に我々は移植された細胞が移植後に生体内で分化しているかどうかを調査した。移植された細胞は6週間後に回収され、免疫組織化学的分析に供された。免疫組織化学的分析の結果によると、スフィアは生体内で三胚葉に由来した組織に分化した(図14)。
(原文)
3.4 Summary of section 3
♦ Spheres differentiated into cells derived from all three germ layers in vivo and in vitro
3.5 Discussion
Spheres differentiated into cells derived from three germ layers in vitro. It is yet answered that it was either differentiation or trans-differentiation. Also it is hard to refer the difference from in vitro differentiation potential of mesenchymal stem cells.
However, at least sphere forming cells enabled to generate various mature cells. In addition, in vivo differentiation assay proved that sphere forming cells were indeed stem cells, but distinct from ES cells in proriferative potential. The relationship between proliferative potential and differentiation potential has yet been understood. Spheres in this study showed differentiation potential which fulfill the critereia for both mesenchymal stem cells and neural stem cells. We believe that the spheres studied contain precursor cells to both mesenchymal and neural stem cells lineages.
It is important to note that cells described above, were propagated as non-adherent spheres, and are not known to exist in vivo. The in vitro behavior of cells in the spheres is likely to be very different from cells that reside in vivo. How these stem cells harbor in adult body and how they exert their potential
The spheres generated seemed to be composed of heterogenous populations of cells,with some markers expressed in some spheres, and other markers expressed in different spheres generated from cells isolated from the same tissue, at the same time. We believe that these differences also may be a function of the environment in which the cells were maintained.
(和訳)
3.4 第三章のまとめ
♦ スフィアは生体内および試験管内で、全三胚葉由来細胞に分化した。
3.5 討論
スフィアは試験管内で三胚葉に由来する細胞に分化した。それは分化または分化転換<訳注:すでに分化した細胞が別の細胞種に転換する現象>のいずれかであると分かっている。また間葉系幹細胞の試験管内分化能との違いに言及することは困難である。
しかし、少なくともスフィア形成細胞はさまざまな成体細胞の生成を可能にした。加えて、生体内分化実験はスフィア形成細胞が実際に幹細胞であることを証明したが、増殖能力においてES細胞と峻別された。増殖能と分化能との関係はもう理解されてきている。この研究におけるスフィアは間葉系幹細胞と神経幹細胞の両方の基準を満たす分化能を示した。私たちは研究しているスフィアに間葉系と神経系の両方の幹細胞系統への前駆細胞が含まれていると信じている。
上述の細胞が非接着性スフィアとして知られ、かつ生体内に存在することが知られていないことに留意することが重要である。スフィア内細胞の試験管内での挙動は生体内に存在する細胞とは非常に異なる可能性が高い。如何にこれらの幹細胞は成体の中にとどまり、そして如何に彼らの潜在能力を伸ばすのか。<訳注:構文が不完全なところも編集中の文章であることを示唆している。>
生成されたスフィアは、細胞の不均一な集団で構成されているようだった。同じ組織から単離された細胞から生成されていながら、同時に、いくつかのスフィアにはいくつかのマーカー発現が伴い、別のスフィアには他のマーカー発現があった。(訳注:ティシュー論文に同様の趣旨の記述がある。Spheres seemed to contain heterogeneous populations of cells, with some markers expressed in some spheres, and other markers expressed in different spheres generated from cells isolated from the same tissue, at the same time. 小保方さんはティシュー論文を下地に博論を書こうとしていることがよくわかる。)我々は、これらの違いはその中で細胞が維持されている環境の関係かなと考えている。
(原文)
Figure 10 in differentiation of bone marrow spheres
After 6 weeks of culture, cells change their figurations into those of cells representative of three germ layers.
Figure 11 In vitro differentiation assay of cells from 3 germ layers.
Marrowspheres were dissociated and plated in each appropriate medium. Cells from spheres,differentiated into cells representative of the three germ layers. Neural cells (left), muscle cells (middle) cells
, hepatocytes (right). Neurons stained with plll tubuline (left),. Muscle cells stained with a-smooth muscle actin (middle). Hepatocytes were stained with a-fetoprotein (right).
(和訳)
図10 骨髄スフィアの分化
6週間培養後、細胞はその形状を三胚葉を代表する細胞のものに変化させる。
図11 三胚葉由来細胞の試験管内分化実験。
骨髄スフィアを解離させ、それぞれ適切な培地に蒔いた。 スフィア由来細胞は三胚葉を代表する細胞に分化する。 神経細胞(左)、筋細胞(中)細胞<訳注:これもティシュー論文のの最後の方に似た以下の文章があって、それをコピペ編集しているから同じエラーが見逃されている。現代っ子の文章作法が原因。Differentiation assay from myospheres(C) into neural cells(i,ii,and iii),muscle cells(iv,v,and vi)cells,and hepatocytes(vii,viii,and ix). > ,肝細胞(右)。ニューロンはplllチューブリンで染色された(左)。筋肉細胞は平滑筋アクチンで染色された(中央)。 肝細胞はα-フェトプロテインで染色された(右)。
(原文)
Figure 12 Mesenchymal lineage differentiation.
Dissociated spheres were plated into serum-containing medium and cultured for 14-21 days. Plated cells differentiated into mesenchymal lineage cells even plated cells were from spheres derived from endoderm or ectoderm tissues.
Marrow spheres differentiated into condrocytes (A), adipocytes (B) and osteocytes (C). Pnemospheres differentiated into condrocytes (D), adipocytes (E) and osteocytes (F). Spinalspheres differentiated into condrocytes (G) and adipocytes (H).
(和訳)
図12 間葉系統の分化。
解離したスフィアを血清含有培地に播種し、14~21日間培養した。 培養された細胞は、培養された細胞が内胚葉または外胚葉組織由来のスフィアからのものであってさえ、間葉系細胞に分化した。
骨髄スフィアは、コンドロサイト(A)、脂肪細胞(B)および骨細胞(C)に分化した。 胚スフィアはコンドロサイト(D)、脂肪細胞(E)および骨細胞(F)に分化した。 脊椎スフィアはコンドロサイト(G)と脂肪細胞(H)に分化した。<訳注:(I)が抜けている。ここでも草稿だと分かる。>
(原文)
Figure 13 Teratoma forming assay
10(to the power of 7)bone marrow cells and ES cells were injected subcutaneously into immunedificienl mice.
After 6 weeks of implantation, cell masses were harvested.
Figure 14 Teratoma like mass from bone marrow spheres contained nerve expressing betalll-tubuline (left)(ectoderm), muscle expressing desmin (middle)(mesoderm) and duct like structure expressing AFP (right)(endoderm).
(和訳)
図13 テラトーマ形成実験
10の7乗個の骨髄細胞およびES細胞を免疫不全マウスに皮下注射した。
移植6週間後、細胞塊を採取した。
図14 骨髄スフィア由来のテラトーマ様腫瘤は、ベータⅢチューブリンを発現する神経(左)(外胚葉)、デスミンを発現する筋肉(中)(中胚葉)およびAFPを発現する管様構造(右)(内胚葉)を含んでいた。
- 2019/08/24(土) 22:54:44|
- 小保方さんの論文
-
-
| コメント:0







