(英文)
Bidirectional developmental potential in reprogrammed cells with acquired pluripotency
Haruko Obokata,1, 2, 3,
Yoshiki Sasai,4,
Hitoshi Niwa,5,
Mitsutaka Kadota,6,
Munazah Andrabi,6,
Nozomu Takata,4,
Mikiko Tokoro,2,
Yukari Terashita,1, 2,
Shigenobu Yonemura,7,
Charles A. Vacanti3,
& Teruhiko Wakayama2, 8,
多能性獲得リプログラム細胞の双方向発生能力
Haruko Obokata
Yoshiki Sasai
Hitoshi Niwa
Mitsutaka Kadota
Munazah Andrabi
Nozomu Takata
Mikiko Tokoro
Yukari Terashita
Shigenobu Yonemura
Charles A. Vacanti
& Teruhiko Wakayama
(英文)
Journal name:
Nature
Volume:
505,
Pages:
676–680
Date published:
(30 January 2014)
DOI:
doi:10.1038/nature12969
雑誌名
ネイチャー
巻:
505,
頁
676–680
公開日
(2014/1/30)
DOI:
doi:10.1038/nature12969
(英文)
Received
10-Mar-13
Accepted
20-Dec-13
Published online
29-Jan-14
Retraction (July, 2014)
受領
2013/3/10
受諾
2013/12/20
オンライン公開
2014/1/29
取下げ(2014年7月)
(英文)
Abstract
We recently discovered an unexpected phenomenon of somatic cell reprogramming into pluripotent cells by exposure to sublethal stimuli, which we call stimulus-triggered acquisition of pluripotency (STAP)1. This reprogramming does not require nuclear transfer2, 3 or genetic manipulation4. Here we report that reprogrammed STAP cells, unlike embryonic stem (ES) cells, can contribute to both embryonic and placental tissues, as seen in a blastocyst injection assay. Mouse STAP cells lose the ability to contribute to the placenta as well as trophoblast marker expression on converting into ES-like stem cells by treatment with adrenocorticotropic hormone (ACTH) and leukaemia inhibitory factor (LIF).
In contrast, when cultured with Fgf4, STAP cells give rise to proliferative stem cells with enhanced trophoblastic characteristics. Notably, unlike conventional trophoblast stem cells, the Fgf4-induced stem cells from STAP cells contribute to both embryonic and placental tissues in vivo and transform into ES-like cells when cultured with LIF-containing medium. Taken together, the developmental potential of STAP cells, shown by chimaera formation and in vitro cell conversion, indicates that they represent a unique state of pluripotency.
概要
我々は最近、亜致死刺激に曝すことによって多能性細胞へリプログラミングされる体細胞の予期しない現象を発見した。我々はそれを刺激惹起性多能性獲得(STAP)[1]と呼ぶ。この再プログラミングは核移植[2][3]または遺伝子操作[4]を必要としない。ここに我々は、再プログラミングされたSTAP細胞が、胚盤胞注入実験に見られるように、胚性幹細胞(ES)とは異なり、胚および胎盤組織の両方に寄与し得ることを報告する。マウスSTAP細胞は、副腎皮質刺激ホルモン(ACTH)、および白血病抑制因子(LIF)で処理することにより、ES様幹細胞に変換する際に、胎盤に貢献する能力ならびに栄養膜マーカー発現を失う。
対して、Fgf4で培養すると、STAP細胞は、強化された栄養膜特性を伴った増殖幹細胞になる。特に、従来の栄養膜幹細胞とは異なり、STAP細胞からFGF4によって誘導された幹細胞は体内で胚および胎盤組織の両方に寄与し、LIF含有培地で培養するとES様細胞に形質転換する。まとめると、キメラの形成と試験管内細胞変換によって示されたSTAP細胞の発生能は、それらが多能性の特殊な状態を表すことを示している。
(英文)
We recently discovered an intriguing phenomenon of cellular fate conversion: somatic cells regain pluripotency after experiencing sublethal stimuli such as a low-pH exposure. When splenic CD45+ lymphocytes are exposed to pH 5.7 for 30 min and subsequently cultured in the presence of LIF, a substantial portion of surviving cells start to express the pluripotent cell marker Oct4 (also called Pou5f1) at day 2. By day 7, pluripotent cell clusters form with a bona fide pluripotency marker profile and acquire the competence for three-germ-layer differentiation as shown by teratoma formation. These STAP cells can also efficiently contribute to chimaeric mice and undergo germline transmission using a blastocyst injection assay.
Although these characteristics resemble those of ES cells, STAP cells seem to differ from ES cells in their limited capacity for self-renewal (typically, for only a few passages) and in their vulnerability to dissociation. However, when cultured in the presence of ACTH and LIF for 7 days, STAP cells, at a moderate frequency, further convert into pluripotent ‘stem’ cells that robustly proliferate (STAP stem cells).
我々は最近細胞運命変換の興味深い現象を発見した。即ち、体細胞が低pHにさらすなどの亜致死刺激を経験した後に多能性を取り戻すというものである。脾臓CD45+リンパ球がpH5.7に30分さらされ、その後LIFの存在下で培養されたとき、生存細胞のかなりの割合が2日目に多能性細胞マーカーOct4(Pou5f1とも呼ばれる)を発現し始める。7日目までに多能性細胞塊が真正な多能性マーカープロファイルをともなってでき、同時に奇形腫形成によって示されるような三胚葉分化能を獲得する。これらのSTAP細胞はまた、胚盤胞注入実験を用いて、確実にキメラマウスに寄与でき、生殖系列伝達を確認できる。
これらの特性は、ES細胞のものに似ているが、STAP細胞は、自己増殖能が弱い点と(典型的にはわずか数継代)、解離脆弱性において、ES細胞と異なっているように見える。 しかし、7日間ACTHおよびLIFの存在下で培養されると、STAP細胞は、かなりの頻度で、さらに、確実に増殖する多能性幹細胞(STAP幹細胞)になる。
(英文)
Here we have investigated the unique nature of STAP cells, focusing on their differentiation potential into the two major categories (embryonic and placental lineages) of cells in the blastocyst. We became particularly interested in this question after a blastocyst injection assay revealed an unexpected finding. In general, progeny of injected ES cells are found in the embryonic portion of the chimaera, but rarely in the placental portion (Fig. 1a; shown with Rosa26-GFP). Surprisingly, injected STAP cells contributed not only to the embryo but also to the placenta and fetal membranes (Fig. 1b and Extended Data Fig. 1a–c) in 60% of the chimaeric embryos (Fig. 1c).
ここでは、胚盤胞内細胞の二つの主要なカテゴリー(胚と胎盤関連)への分化能に焦点を当て、STAP細胞の特殊な性質を調査した。我々は胚盤胞注入実験が意外な発見を明らかにした後、この疑問に特に興味を持つようになった。一般的には、注入されたES細胞の所産はキメラの胚部分に見いだされるが、めったに胎盤部分には見いだされ無い(図1A、Rosa26-GFPで示されている)。驚くべきことに、STAP細胞は、キメラ胚の60%において(図1c)、胚のみならず胎盤と卵黄嚢(図1b及び拡張データ図1a-c)に貢献した。
(英文)
Figure 1: STAP cells contribute to both embryonic and placental tissues in vivo.
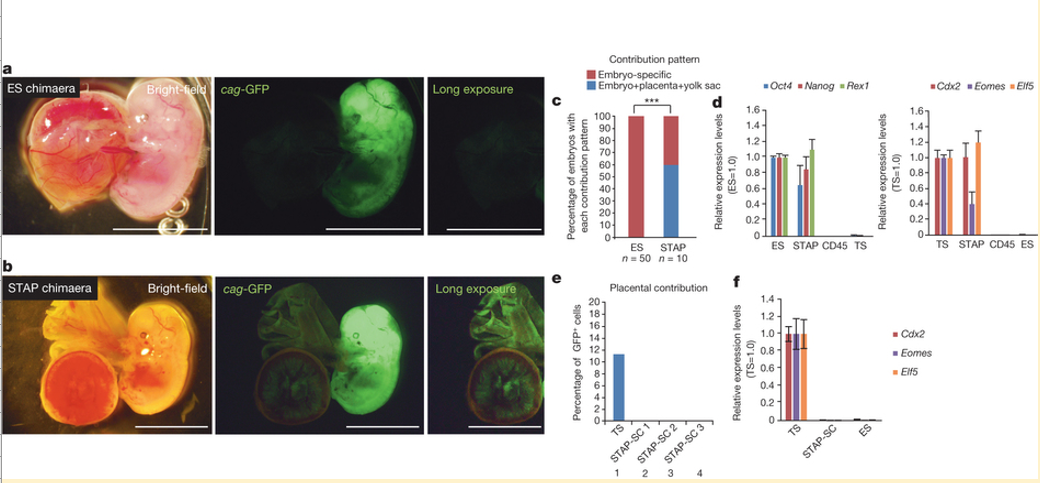
a, b, E12.5 embryos from blastocysts injected with ES cells (a) and STAP cells (b). Both cells are genetically labelled with GFP driven by a constitutive promoter. Progeny of STAP cells also contributed to placental tissues and fetal membranes (b), whereas ES-cell-derived cells were not found in these tissues (a). Scale bar, 5.0 mm. c, Percentages of fetuses in which injected cells contributed only to the embryonic portion (red) or also to placental and yolk sac tissues (blue). ***P < 0.001 with Fisher’s exact test. d, qPCR analysis of FACS-sorted Oct4-GFP-strong STAP cells for pluripotent marker genes (left) and trophoblast marker genes (right). Values are shown as ratio to the expression level in ES cells. Error bars represent s.d.
e, Contribution to placental tissues. Unlike parental STAP cells and trophoblast stem (TS) cells, STAP stem cells (STAP-SCs) did not retain the ability for placental contributions. Three independent lines were tested and all showed substantial contributions to the embryonic portions. f, qPCR analysis of trophoblast marker gene expression in STAP stem cells. Error bars represent s.d.
図1:STAP細胞は、体内実験で、胚および胎盤の両方の組織に寄与する。
a, b,ES細胞(a)およびSTAP細胞(b)を注入後の胚盤胞からのE12.5胚。どちらの細胞も、遺伝子操作により、構成的プロモーターで駆動されるGFP標識されている。 ES細胞由来の細胞はこれらの組織で検出されなかったのに対し(a)、STAP細胞の所産はまた、胎盤組織および胎児の膜(b)に貢献した。スケールバー、5.0 mm。 c, 注入された細胞が胚部分(赤)にのみ貢献したか、或いは胎盤と卵黄嚢組織(青)にも貢献しているかの胎児のパーセンテージ 。*** フィッシャーの正確確率検定P値<0.001。 d, 多能性マーカー遺伝子(左)と栄養膜マーカー遺伝子(右)に関する、FACSソートしたOct4-GFP-強発現STAP細胞の定量PCR分析。値はES細胞における発現レベルに対する比として示している。エラーバーは±標準偏差を表す。<訳注 s.d.=standard deviation>
e, 胎盤組織への貢献。親のSTAP細胞と栄養膜幹(TS)細胞とは異なり、STAP幹細胞(STAP-SCs)は、胎盤貢献能を保持していなかった。三つの独立した系統を試験し、すべて胚の部分には多大な貢献を示した。 f,STAP幹細胞の栄養膜マーカー遺伝子発現の定量PCR分析。エラーバーは±標準偏差を表す。
(英文)
In quantitative polymerase chain reaction (qPCR) analysis, STAP cells (sorted for strong Oct4-GFP signals) expressed not only pluripotency marker genes but also trophoblast marker genes such as Cdx2 (Fig. 1d and Supplementary Table 1 for primers), unlike ES cells. Therefore, the blastocyst injection result is not easily explained by the idea that STAP cells are composed of a simple mixture of pluripotent cells (Oct4+Cdx2-) and trophoblast-stem-like cells (Oct4-Cdx2+).
In contrast to STAP cells, STAP stem cells did not show the ability to contribute to placental tissues (Fig. 1e, lanes 2–4), indicating that the derivation of STAP stem cells from STAP cells involves the loss of competence to differentiate into placental lineages. Consistent with this idea, STAP stem cells show little expression of trophoblast marker genes (Fig. 1f).
定量ポリメラーゼ連鎖反応(qPCR)分析では、(Oct4-GFPシグナル強発現選別された)STAP細胞はES細胞とは異なり、多能性マーカー遺伝子だけでなく、Cdx2のような栄養膜マーカー遺伝子(図1dおよびプライマーのための補足表1)を発現した。したがって、胚盤胞注入結果は、STAP細胞が、多能性細胞(Oct4+ Cdx2-)と栄養膜幹細胞様細胞(Oct4-Cdx2+)との単純な混合で構成されているという考えでは容易に説明されない
STAP細胞とは対照的に、STAP幹細胞は、胎盤組織に貢献する能力を示さなかった(図1e 2-4レーン)。このことはSTAP細胞からSTAP幹細胞への誘導は、胎盤関連への分化能の喪失を伴うことを示している。その証拠にSTAP幹細胞は栄養膜マーカー遺伝子をほとんど発現しない(図1f)。
(英文)
We next examined whether an alteration in culture conditions could induce in vitro conversion of STAP cells into cells similar to trophoblast stem cells, which can be derived from blastocysts during prolonged adhesion culture in the presence of Fgf4. When we cultured STAP cell clusters under similar conditions (Fig. 2a; one cluster per well in a 96-well plate), flat cell colonies grew out by days 7–10 (Fig. 2b, left; typically in ~30% of wells). The Fgf4-induced cells strongly expressed the trophoblast marker proteins integrin α7 (Itga7) and eomesodermin (Eomes) (Fig. 2c, d) and marker genes (for example, Cdx2; Fig. 2e).
我々は、次に、培養条件の変更で、STAP細胞から栄養膜幹細胞に似た細胞への試験管内変換を誘導できるかどうかを調べた。栄養膜幹細胞はFgf4の存在下で長期接着培養中の胚盤胞から誘導することができる。同様の条件下でSTAP細胞塊を培養した場合(図2a、96ウェルプレートにおけるウェルあたり1クラスタ)、7日から10日までの間に扁平な細胞コロニーが成長してきた(図2b、左:典型的には、ウェルの30%内 )。Fgf4誘導細胞は栄養膜マーカー蛋白質であるインテグリンα7(Itga7)とエオメソダミン(Eomes)(図2c,d)及びマーカー遺伝子(たとえばCdx2;図2e)を強く発現した。
- 2019/05/14(火) 08:41:25|
- レター論文
-
-
| コメント:0
(英文)
Figure 2: Fgf4 treatment induces some trophoblast-lineage character in STAP cells.
a, Schematic of Fgf4 treatment to induce Fgf4-induced stem cells from STAP cells. b, Fgf4 treatment promoted the generation of flat cell clusters that expressed Oct4-GFP at moderate levels (right). Top and middle: days 1 and 7 of culture with Fgf4, respectively. Bottom: culture after the first passage. Scale bar, 50 μm. c, d, Immunostaining of Fgf4-induced cells with the trophoblast stem cell markers integrin α7 (c) and eomesodermin (d). Scale bar, 50 μm. e, qPCR analysis of marker expression. f, g, Placental contribution of Fgf4-induced stem cells (FI-SCs) (genetically labelled with constitutive GFP expression). Scale bars: 5.0 mm (f (left panel) and g); 50 µm (f, right panel). In addition to placental contribution, Fgf4-induced stem cells contributed to the embryonic portion at a moderate level (g).
h, Quantification of placental contribution by FACS analysis. Unlike Fgf4-induced cells, ES cells did not contribute to placental tissues at a detectable level. i, Cluster tree diagram from hierarchical clustering of global expression profiles. Red, approximately unbiased P values. j, qPCR analysis of Fgf4-induced cells (cultured under feeder-free conditions) with or without JAK inhibitor (JAKi) treatment for pluripotent marker genes. k, qPCR analysis of FI-SCs with or without JAK inhibitor (JAKi) treatment for trophoblast marker genes. Values are shown as ratio to the expression level in ES cells (j) or trophoblast stem cells (k). ***P < 0.001; NS, not significant; t-test for each gene between groups with and without JAK inhibitor treatment. n = 3. Statistical significance was all the same with three pluripotency markers. None of the trophoblast marker genes showed statistical significance. Error bars represent s.d.
図2:Fgf4処理は、STAP細胞においていくつかの栄養膜関連性質を誘導する。
a,STAP細胞からのFgf4誘導幹細胞を誘導するFgf4処置の概略図。 b,Fgf4処理は中程度のレベルでOct4-GFPを発現する扁平細胞塊の生成を促進した(右)。上段と中段:Fgf4によるそれぞれ1日目と7日目の培養。下段:最初の継代後の培養。スケールバーは50μm。 c, d, 栄養膜幹細胞マーカーであるインテグリンα7(c)とエオメソダミン(d)のFgf4誘導細胞の免疫染色。スケールバー、50μm。 e,マーカー発現の定量PCR分析。 f, g,Fgf4誘導幹細胞(FI-SCs)の胎盤の寄与(構造的GFP発現で遺伝子操作標識されている)。スケールバー:5.0mm(fの左パネルおよびg);50µm(fの右パネル)。胎盤の寄与に加えて、Fgf4誘導幹細胞は、中程度のレベルでの胚部分にも貢献した(g)。
h, FACS分析による胎盤貢献の定量化。 Fgf4誘導細胞とは異なり、ES細胞は検出可能なレベルで胎盤組織に寄与しなかった。 i, 網羅的発現特性階層的分類による分類系統樹図。赤字はほぼ公平なP値。 j,多能性マーカー遺伝子のためのJAK阻害剤(JAKi)処置の有無で分けられた(フィーダー無し条件下で培養された)Fgf4誘導細胞のqPCR分析。 k,栄養膜幹細胞マーカー遺伝子へのJAK阻害剤(JAKi)処置の有無で分けられたFI-SCsのqPCR分析。値はES細胞(j)または栄養膜幹細胞(k)の中の発現レベルに対する比として示されている。 *** P <0.001; NS、重要でない;JAK阻害剤処理の有無によるグループ間の各遺伝子についてのt検定。 N = 3。三つの多能性マーカーの統計的有意性はまったく同じであった。栄養膜幹細胞のマーカー遺伝子のいずれも統計的有意性を示さなかった。エラーバーは±標準偏差を表す。
(英文)
These Fgf4-induced cells with trophoblast marker expression could be expanded efficiently in the presence of Fgf4 by passaging for more than 30 passages with trypsin digestion every third day. Hereafter, these proliferative cells induced from STAP cells by Fgf4 treatment are referred to as Fgf4-induced stem cells. This type of derivation into trophoblast-stem-like cells is not common with ES cells (unless genetically manipulated)<13> or STAP stem cells.
In the blastocyst injection assay, unlike STAP stem cells, the placental contribution of Fgf4-induced stem cells (cag-GFP-labelled) was observed with 53% of embryos (Fig. 2f, g; n = 60). In the chimaeric placentae, Fgf4-induced stem cells typically contributed to ~10% of total placental cells (Fig. 2h and Extended Data Fig. 2a, b).
栄養膜マーカー発現を伴うこれらのFgf4誘導細胞は、Fgf4存在下で、三日毎のトリプシン分離処理で30継代以上の間継代することにより効率的に増殖することができた。それより後、Fgf4処理によりSTAP細胞から誘導されたこれらの増殖細胞はFgf4誘導幹細胞と呼ぶことにする。栄養膜幹様細胞様細胞へのこのタイプの派生物は、ES細胞とも(遺伝子操作しない限り)、STAP幹細胞とも同じものではない。
胚盤胞注入実験において、STAP幹細胞とは異なり、Fgf4誘導幹細胞(CAG-GFP標識)の胎盤寄与は胚の53%で観察された(図2f,g; n=60)。キメラ胎盤では、Fgf4誘導幹細胞は典型的な例では全胎盤細胞の最大10%に貢献する(図2h及び拡張データ図2a,b)。
(英文)
Despite their similarities, we noted that Fgf4-induced stem cells also possessed some critical differences compared with blastocyst-derived trophoblast stem cells. First, Fgf4-induced stem cells exhibited moderate GFP signals and expressed a moderate level of Oct4 (Fig. 2b; moderate and low levels of immunostaining signals were also seen for Oct4 and Nanog proteins, respectively; Extended Data Fig. 2c), unlike conventional trophoblast stem cells that have little Oct4 expression (Fig. 2e). Second, unlike trophoblast stem cells, blastocyst-injected Fgf4-induced stem cells also contributed to embryonic tissues (in all cases that involved chimaeric placentae; n = 32), although the extent of contribution was generally modest (Fig. 2g).
Third, immunostaining revealed that the level of Cdx2 protein accumulation in the nuclei of Fgf4-induced stem cells was marginal as compared to the cytoplasmic level, although the transcript expression level was substantial (Fig. 2e). This may suggest complex and dynamic post-transcriptional regulations for this key transcription factor in Fgf4-induced stem cells (a similar situation was seen for STAP cells, in which clear nuclear localization was not observed for either Cdx2 or Eomes, despite substantial expression of their transcripts). Fourth, in the absence of Fgf4, Fgf4-induced stem cells gradually died in 7–10 days and did not differentiate into large and multi-nuclear cells, unlike trophoblast stem cells (Extended Data Fig. 2d).
それらの類似性にもかかわらず、我々はFgf4誘導幹細胞は、胚盤胞由来栄養膜幹細胞と比較していくつかの重要な違いを持っていたことを指摘した。第一に、従来の栄養膜幹細胞がOct4蛋白発現が皆無であるのに対して(図2e)、Fgf4誘導幹細胞は適度なGFPシグナルを示し、そして適度なレベルOct4蛋白を発現した(図2b;中程程度および低いレベルで免疫染色シグナルが、それぞれ、Oct4とNanog蛋白質について見られた;拡張データ図2c)。第二に、栄養膜幹細胞とは異なり、胚盤胞に注入したFgf4誘導幹細胞は、寄与の程度は、一般的に控えめではあるものの(図2g)、胚組織にも寄与した(キメラ胎盤を含むすべてのケースにおいて;n = 32)、
第三に、免疫染色は、細胞質内のレベルと比較して、転写産物発現レベルが実体的であったのに対して(図2e)、Fgf4誘導幹細胞の核内のCdx2蛋白質の蓄積レベルがわずかであることを明らかにした。これはFgf4誘導幹細胞の主要な転写因子にとっての複雑で動的な転写後規制を示唆しているのかもしれない(同様の状況がSTAP細胞に見られた。STAP細胞の中では、それらの転写の実態的表出があるにも関わらず、Cdx2またはEomesのいずれについても明確な核局在が観察されなかった。第四に、栄養膜幹細胞(拡張データ図2d)とは異なり、Fgf4非存在下では、Fgf4誘導幹細胞は徐々に7日から10日内に死滅し、大きく多能な核細胞に分化しなかった。
(英文)
To investigate the relationship among STAP cells, STAP stem cells, Fgf4-induced stem cells, ES cells and trophoblast stem cells, we performed genome-wide RNA-sequencing analysis (Fig. 2i for dendrogram; Extended Data Figs 3 and 4 for expression analyses of representative genes ; Supplementary Tables 2 and 3 for analysis conditions). Whereas STAP cells formed a cluster with STAP stem cells, Fgf4-induced stem cells, ES cells and trophoblast stem cells and not with the parental CD45+ cells, STAP cells were an outlier to the rest of the cell types in the cluster. In contrast, STAP stem cells were closely clustered with ES cells. Fgf4-induced stem cells formed a cluster with a sub-cluster of ES cells and STAP stem cells, whereas trophoblast stem cells comprised an outlier to this cluster, indicating a close relationship of Fgf4-induced stem cells with these pluripotent cells.
However, as Fgf4-induced stem cells lay between STAP stem cells and trophoblast stem cells in the dendrogram, the possibility of contamination of STAP stem cells in the Fgf4-induced stem-cell population cannot be ruled out. Previous studies have indicated that inner cell mass (ICM)-type pluripotent cells can be removed from culture by treating the culture with a JAK inhibitor <16>(Extended Data Fig. 5a, b). In contrast, the JAK inhibitor treatment had no substantial effect on Oct4-GFP expression in Fgf4-induced stem-cell culture (Extended Data Fig. 5c, d; see Extended Data Fig. 5e, f for control). Expression of neither pluripotency markers (Fig. 2j) nor trophoblast markers (Fig. 2k) was substantially affected, indicating that pluripotency marker expression is unlikely to reflect contaminating STAP stem cells (ICM-type). Consistent with this idea, Fgf4-induced stem cells that were strongly positive for the trophoblast marker Itga7 (a surface marker for trophoblasts but not ES cells) also expressed high levels of Oct4-GFP (Extended Data Fig. 5g).
STAP細胞、STAP幹細胞、Fgf4誘導幹細胞、ES細胞及び栄養膜幹細胞との関係を調べるために、我々は全ゲノムRNA配列決定分析を行った(図2i 系統樹用;拡張データ図3と4 代表的遺伝子の発現解析用;補足表2と3 分析条件用)。STAP細胞は、親のCD45陽性と違って、STAP幹細胞、Fgf4誘導幹細胞、ES細胞および栄養膜幹細胞と同じく細胞塊を形成する一方、STAP細胞は、細胞塊の中で他の細胞タイプとは違って特異であった。対照的に、STAP幹細胞はES細胞に近い細胞塊形成をした。Fgf4誘導幹細胞は、ES細胞およびSTAP幹細胞のサブクラスターに近いクラスターを形成し、一方、栄養膜幹細胞はこのクラスターに異常値を含み、Fgf4誘導幹細胞とこれらの多能性細胞との密接な関係を示した。
しかしながら、Fgf4誘導幹細胞は、樹状図においてSTAP幹細胞と栄養膜幹細胞との間に位置しているので、Fgf4誘導幹細胞集団におけるSTAP幹細胞の混入の可能性を排除できない。先行する研究では、内部細胞塊(ICM)タイプの多能性細胞は、JAK阻害剤で培養を処理することにより培養物から除去することができることを示した(拡張データ図5a,b)。対して、JAK阻害剤処置は、Fgf4誘導幹細胞培養のOct4-GFPの発現には実質的な影響を及ぼさなかった。(拡張データ図5c,d;コントロールとして拡張データ図5e,f参照)。どの多能性マーカー(図2j)や栄養膜マーカー(図2k)も実質的影響を被らなかった。これは多能性マーカー発現がSTAP幹細胞(ICMタイプ)を反映している可能性の低いことを示している。それを証明するように、栄養膜マーカーであるItga7(ES細胞ではなく、栄養膜の表面マーカ)に対して強く陽性であったFgf4誘導幹細胞はOct4-GFP(拡張データ図5g)を高レベルで発現した(拡張データ図5g)。
(英文)
Notably, when cultured in LIF+FBS-containing medium for 4 days, Fgf4-induced stem cells underwent substantial changes in morphology and started to form ES-cell-like compact colonies with strong GFP signals (Fig. 3a). These cells showed expression of pluripotency makers, but not trophoblast markers (Fig. 3b and Extended Data Fig. 6a), and formed teratomas in mice (Extended Data Fig. 6b). These ES-like cells were generated from Fgf4-induced stem cells sorted for strong expression of the trophoblast marker Itga7, but rarely from Itga7-dim cells (Fig. 3c, d).
特に4日間LIF+ FBS含有培地で培養すると、Fgf4誘導幹細胞は、形態学的に実質的な変化を受け、強いGFPシグナル(図3a)を有するES細胞様のコンパクトなコロニーを形成し始めた。これらの細胞は、多能性メーカーの発現を示したが、栄養膜マーカーは示さず(図3b及び拡張データ図6a)、かつマウスにおいてテラトーマを形成した(データ図。拡張図6b)。これらのES様細胞は栄養膜マーカーItga7の強発現しているFgf4誘導幹細胞から生成されたが、まれにItga7-DIM細胞からも生成された(図3c、d)。
(英文)
Figure 3: Fgf4 treatment induces some trophoblast-lineage character in STAP cells.
a, Culture of Oct4-GFP Fgf4-induced cells in LIF + 20% FBS medium. b, qPCR analysis of ES-like cells derived from Fgf4-induced cells for pluripotent marker genes (left) and trophoblast marker genes (right). Values are shown as ratio to the expression level in ES cells (left) or trophoblast stem (TS) cells (right). c, d, Culture of Oct4-GFP Fgf4-induced cells sorted by FACS for strong integrin α7 (Itga7) expression in LIF + 20% FBS medium. d, Formation frequency (shown by percentage) of Oct4-GFP+ colonies from cells plated on gelatin-coated dishes at a clonal density. **P < 0.01; t-test; n = 3. e, f, Culture of Oct4-GFP Fgf4-induced cells (dissociated) in LIF + 20% FBS medium with MEK inhibitor. **P < 0.01; NS, not significant; Tukey’s test; n = 3.
e, No substantial formation of Oct4-GFP+ colonies was seen from Fgf4-induced cells in the presence of MEK inhibitor (left), whereas colonies frequently formed when cells were co-plated with Oct4-GFP ES cells (right; plated cells were 1/20 of Fgf4-induced cells). f, Quantification of colony formation per plated cells (1 × 103 Fgf4-induced cells and/or 1 × 103 ES cells). Unlike Fgf4-induced cells, ES cells formed colonies (regardless of co-plating with FI-SCs) in the presence of MEK inhibitor. Bars and error bars represent mean values and s.d., respectively (b, d, f). Scale bars: 100 μm (a, c, e).
図3:Fgf4処理は、STAP細胞においていくつかの栄養膜の系統特性を誘導する。
a, LIF + 20%FBS培地中でのOct4-GFP FGgf4誘導細胞の培養。 b,多能性マーカー遺伝子(左)と栄養膜マーカー遺伝子(右)のFgf4誘導細胞由来ES様細胞の定量PCR分析。値はES細胞(左)と栄養膜幹細胞(TS)(右)の発現レベルの比で示されている。 c, d, LIF + 20%FBS培地中でインテグリンα7(Itga7)の強発現しているものをFACSソートしたOct4-GFP Fgf4誘導細胞の培養。 d,クローン密度でゼラチンコートディッシュに播種した細胞からのOct4-GFP 陽性コロニーの形成頻度(パーセンテージで示す)。 ** P <0.01;t検定; n = 3 。 e, f, MEK阻害剤入りLIF+ 20%FBS培地での(解離された)Oct4-GFP Fgf4誘導細胞の培養。 ** P <0.01; NS,重要でない;ターキーテスト;n=3。
e,MEK阻害剤(左)の存在下で、Fgf4誘導細胞からOct4-GFP陽性コロニーの実質的な形成は見られなかった。他方、同時播種したOct4-GFP ES細胞(右;播種した細胞はFgf4誘導細胞の1/20だった)からはコロニーが頻繁に形成された。 f,播種した細胞当たりのコロニー形成の定量(1×10の3乗 Fgf4誘導細胞及び/又は1×10の3 乗ES細胞)。 Fgf4誘導細胞とは異なり、ES細胞はMEK阻害剤の存在下で(FI-SC共培養にも関わらず)コロニーを形成した。バーおよびエラーバーはそれぞれ(b,d,f)平均値とsdを表す。スケールバー:100ミクロン(a,c,e)。
(英文)
To confirm further that Fgf4-induced stem cells with a trophoblast-like nature were converted into ES-like cells, rather than just selecting ES-like cells pre-existing in the Fgf4-induced stem cell culture, we examined the effect of the MEK inhibitor PD0325901 on the ES-like cell generation from Fgf4-induced stem cells. Like trophoblast stem cells, Fgf4-induced stem-cell survival is dependent on FGF–MEK signals, and the inhibition of MEK activity caused massive cell death (Extended Data Fig. 6c). However, PD0325901 is also known to be a main effector in 2i medium[17] and to promote ES cell maintenance. Addition of PD0325901 to LIF+FBS-containing medium strongly inhibited the formation of ES-like colonies from Fgf4-induced stem cells (Fig. 3e, left, and Fig. 3f). This inhibition was unlikely to be due to secondary toxic effects from massive cell death of Fgf4-induced stem cells, as colonies formed in the presence of PD0325901 when ES cells were co-plated in the same culture with Fgf4-induced stem cells (Fig. 3e, right, and Fig. 3f).
Collectively, these findings demonstrate that STAP-derived Fgf4-induced stem cells not only express both pluripotency markers and trophoblast genes but also have the potential to convert into ES-like cells when cultured in LIF+FBS-containing medium (Fig. 4a).
単にFgf4誘導幹細胞の培養皿の中にあらかじめ存在していたES様細胞を選別してきたのではなく、栄養膜様の性質を有するFgf4誘導幹細胞がES様細胞に変換したのだということをさらに確認するために、我々は、Fgf4誘導幹細胞からES様細胞への生成に関して、MEK阻害剤、あるいはPD0325901の効果を調べた。栄養膜幹細胞のように、Fgf4誘導幹細胞の生存はFGF-MEKシグナルに依存しており、MEK活性を阻害すると大量の細胞死を引き起こした(拡張データ図6c)。しかし、またPD0325901は2i培地[17]の主要要素で、ES細胞の維持を促進することが知られている。 LIF + FBS含有培地にPD0325901を添加するとFgf4誘導幹細胞からのES様コロニーの形成を強く阻害した(図3e、左、および図3f)。 ES細胞がFgf4誘導幹細胞と同一の培養皿で共培養されていて、PD0325901の存在下でコロニーが形成されたのであるから、この阻害はFgf4誘導幹細胞の大量細胞死からの二次毒性効果の所為ではないようだ( 図3e、右、および図3f)。
まとめると、これらの知見は、STAP由来Fgf誘導幹細胞は、多能性マーカーおよび栄養膜遺伝子の両方を発現するだけでなく、LIF+ FBS含有培地中で培養するとES様細胞に変換する能力をも有することを示している(図4a)。
(英文)
Figure 4: Differentiation potential and epigenetic state of STAP and STAP-derived stem cells.
a, Schematic diagram of stem-cell conversion cultures from STAP cells under different conditions. b, ChIP-sequencing results of histone H3K4 (green) and H3K27 (red) trimethylation at the loci of pluripotent marker genes (left), bivalent pattern genes (middle) and trophoblast marker genes (right). Scale bars indicate 10 kb for pluripotency marker genes and trophoblast marker genes, and 20 kb for bivalent pattern genes.
図4:STAPおよびSTAP由来幹細胞の分化能および後成的(エピジェネティック)状態。
a, 異なる諸条件下でのSTAP細胞から幹細胞への変換培養模式図。 b, 多能性マーカー遺伝子(左)、二価パターン遺伝子(中央)および栄養膜マーカー遺伝子(右)の遺伝子座での、ヒストンH3K4(緑)およびH3K27(赤)のトリメチル化のChIPシーケンシング結果。スケールバーは、多能性マーカー遺伝子と栄養膜マーカー遺伝子は10 kb、二価パターン遺伝子のは20kbを示す。
(英文)
Here we demonstrate that STAP cells, which have a limited self-renewal ability, can be induced to generate two distinct types of robustly self-renewing stem cells—STAP stem cells and Fgf4-induced stem cells—under different culture conditions. Chromatin immunoprecipitation (ChIP) sequencing analysis showed distinct accumulation patterns of modified histone H3 in the two types of STAP-cell-derived stem cells (Fig. 4b). STAP stem cells (as well as STAP cells) had accumulation patterns of H3K4 and H3K27 trimethylation that resembled those of ES cells at the loci of pluripotency marker genes (Oct4, Nanog, Sox2), bivalent pattern genes18 (Gata2, brachyury, Nkx6-2) and trophoblast marker genes (Cdx2, Eomes, Itga7). In contrast, the accumulation patterns in Fgf4-induced stem cells at these loci matched more closely those of trophoblast stem cells, except that low levels of accumulation of H3K4 trimethylation in Oct4 and Nanog and of H3K27 trimethylation in the trophoblast marker genes were observed in Fgf4-induced stem cells but not trophoblast stem cells.
ここでは、限られた自己再生能しか持たないSTAP細胞を、異なる培養条件下で、STAP幹細胞とFgf4誘導幹細胞という、二つの異なるタイプの、確実に自己再生する幹細胞に生成するように誘導することができることを示す。クロマチン免疫沈降法(ChIP)配列決定分析は、二種類のタイプのSTAP細胞由来幹細胞において、修飾されたヒストンH3の厳密な蓄積パターンを示した(図4b)。(STAP細胞と同様に) STAP幹細胞は多能性マーカー遺伝子(Oct4、Nanog、Sox2)、二価パターン遺伝子[18](Gata2, brachyury, Nkx6-2)、および栄養膜マーカー遺伝子(Cdx2の、Eomes、Itga7)の遺伝子座において、ES細胞のものに似たH3K4及びH3K27のトリメチル化蓄積パターンを持つ。対して、FGF4誘導幹細胞における同様の遺伝子座の蓄積パターンはより密接にトロホブラスト幹細胞のものと一致した。ただし、Oct4とNanogにおけるH3K4のトリメチル化、及びトロホブラストのマーカー遺伝子におけるH3K27のトリメチル化のレベルの低さがFgf4誘導細胞では観察されたが、栄養膜幹細胞では見られない。
(英文)
Recent studies have also begun to reveal dynamic regulations in multiple cellular states related to pluripotency. These include reports of co-expression of Oct4 and Cdx2 in rat ES cells maintained in the presence of a GSK-3β inhibitor[19][20] and of Oct4 expression in rat extra-embryonic precursors[21].Another recent study has indicated that conventional ES cell culture also contains a very minor population of Oct4- cells with features resembling those of very early-stage embryos, including bidirectional potential[22]. However, these cells are dissimilar to STAP cells as they are Oct4-, unlike STAP cells and Fgf4-induced stem cells. Our preliminary genome-wide RNA-sequencing analysis indicated that both morulae and blastocysts are outliers to the cluster of STAP and ES cells (Extended Data Fig. 6d–f and Supplementary Tables 4 and 5).
最近の研究はまた、多能性細胞状態の動的制御を明らかにし始めている。これらのなかには、ラットES細胞で、GSK-3βinhibitor[19][20]の存在下で、Oct4およびCdx2の共発現の報告、ラット胚外前駆体[21]におけるOct4発現の報告がある。他の最近の研究では、従来のES細胞培養でも、双方向に向かえる能力を示す、極めて早期段階の胚に似た特徴を有するOct4陰性細胞の僅かな集団が含まれていることを示唆している[22]。しかしながら、これらの細胞は、STAP細胞ともFgf4誘導幹細胞とも異なり、Oct4陰性状態でのSTAP細胞とも似ていない。我々の予備的ゲノムワイドRNA配列決定分析は、桑実胚と胚盤胞の両方ともSTAP細胞とES細胞塊に対して異常値であることを示した(拡張データ図6d-fと補足表4および5)。
(英文)
A key conclusion drawn from this study is that the reprogramming in STAP conversion goes beyond the pluripotent state of ES cells and involves the acquisition of a wider developmental potential related to both ICM- and trophoectoderm-like states. Because of the inability to clone STAP cells from single cells, we must await future technical advancement to examine whether their dual-directional differentiation potential at the population level may reflect one totipotent state at the single-cell level or two different states of STAP cells coexisting (or fluctuating between them) in culture. As for STAP-cell-derived Fgf4-induced stem cells, which can also contribute to both embryonic and placental tissues, our in vitro conversion study combined with inhibitor treatments clearly indicate that the bidirectional potential of Fgf4-induced stem cells is unlikely to reflect the co-presence of separate subpopulations of ES-like and trophoblast-stem-like cells in the culture. Collectively, our study indicates that STAP-based conversion can reprogram somatic cells to acquire not only pluripotency but also the ability of trophoblast differentiation.
この研究から導かれた要所の結論は、STAP変換のリプログラミングは、ES細胞の多能性状態を超えて、インナーセルマスと栄養膜細胞様状態の両方に関連する広い発生能の獲得を伴うことである。単一細胞からのSTAP細胞を増殖することができないために、我々は将来の技術的進歩を待たなければならない。集団レベルでの双方向分化能を単一細胞レベルで、一つの全能性状態なのか、或いはSTAP細胞の二つの異なる状態が培養皿の中に共存しているのかどうか(またはそれらの間を変動しているのかどうか)を確かめることができるようになるまで。STAP細胞由来Fgf4誘導幹細胞に関して言えば、それは胚およびまた胎盤組織の両方に寄与することができるものであるが、我々の阻害剤処理と組み合わせた試験管内転換研究は、Fgf4誘導幹細胞の双方向能力が培養皿の中にES様および栄養膜幹細胞様細胞の個別の細胞集団がコンタミしているようではないことを明らかに示している。総じて、我々の研究は、STAPを基盤とした転換が体細胞をリプログラムして、多能性だけでなく栄養膜分化能をも獲得させることを示している。
- 2019/05/14(火) 08:58:48|
- レター論文
-
-
| コメント:0
(英文)
Methods
Animal studies
Research involving animals complied with protocols approved by the Harvard Medical School/Brigham and Women’s Hospital Committee on Animal Care, and the Institutional Committee of Laboratory Animal Experimentation of the RIKEN Center for Developmental Biology.
方法
動物研究
動物を対象とした研究は、ハーバード大学医学部/ブリガム・ウィミンズ病院の動物実験委員会、理化学研究所発生生物学センターの研究所実験動物組織委員会の承認を受けた。
(英文)
Cell culture
STAP cells were generated from low-pH-treated CD45+ cells, followed by culture in B27 + LIF medium for 7 days, as described1. For Fgf4-induced stem-cell line establishment, STAP cell clusters were transferred to Fgf4-containing trophoblast stem-cell medium9 on MEF feeder cells in 96-well plates. In most cases (40 out of 50 experiments), colonies grew in 10–50% of wells in 96-well plates. In minor cases (10 out of 50 experiments), no colony growth was observed and/or only fibroblast-like cells appeared. The cells were subjected to the first passage during days 7–10 using a conventional trypsin method. Subsequent passages were performed at a split ratio of 1:4 every third day before they reached subconfluency.
STAP stem-cell lines were established as described1. STAP spheres were transferred to ACTH-containing medium1 on MEF feeder cells (several spheres, up to a dozen spheres, per well of 96-well plates). Four to seven days later, the cells were subjected to the first passage using a conventional trypsin method, and suspended cells were plated in ES maintain medium containing 20% FBS. Subsequent passaging was performed at a split ratio of 1:10 every second day before they reached subconfluency.
細胞培養
STAP細胞は、低pH処理CD45 陽性細胞から生成され、続いて既述の通り[1]、B27 + LIF培地中で7日間培養された。 Fgf4誘導幹細胞株樹立ために、STAP細胞クラスターを、96ウェルプレート中のMEFフィーダー細胞上のFgf4含有栄養膜幹細胞培地[9]に移した。 ほとんどの場合(50回の実験のうち40回)、96ウェルプレートの10~50%のウェルでコロニーが増殖した。 稀に(50回の実験のうち10回)、コロニーの成長は観察されないか、または、線維芽細胞様細胞のみが出現した。 細胞は、従来のトリプシン法を用いて7~10日目の間に第1継代に供された。 その後の継代は、サブコンフルに達する前に、3日ごとに1:4の分裂比で実行された。
STAP幹細胞株は既述の通りに[1]樹立された。 STAPスフィアを、MEFフィーダー細胞上のACTH含有培地[1]に移した(96ウェルプレートのウェル当たり、数スフィア、最大12スフィア)。 4~7日後、通常のトリプシン法を用いて細胞を第1継代に供し、懸濁した細胞を20%FBSを含むES維持培地に播種した。 その後の継代は、サブコンフルに達する前に2日ごとに1:10の分割比で行われた。
(英文)
Chimaera mouse generation and analyses
For production of diploid and tetraploid chimaeras with STAP cells, STAP stem cells and Fgf4-induced stem cells, diploid embryos were obtained from ICR strain females. Tetraploid embryos were produced by electrofusion of 2-cell embryos. Because trypsin treatment of donor samples turned out to cause low chimaerism, STAP spherical colonies were cut into small pieces using a microknife under microscopy, and small clusters of STAP cells were then injected into day-4.5 blastocysts by a large pipette. Next day, the chimaeric blastocysts were transferred into day-2.5 pseudopregnant females.
キメラマウスの作成と分析
STAP細胞、STAP幹細胞およびFgf4誘導幹細胞からの、二倍体および四倍体キメラの作成のために、二倍体胚をICR系統の雌から得た。 四倍体胚は2細胞胚の電気融合によって作成された。 ドナー試料のトリプシン処理は低キメニズムを引き起こすことが判明したので、顕微鏡下でマイクロナイフを用いてSTAP球状コロニーを小片に切断し、STAP細胞の小さなクラスターを大型ピペットで4.5日の胚盤胞に注入した。 翌日、キメラ胚盤胞を2.5日の偽妊娠雌に移した。
(英文)
In vivo differentiation assay
1 × 10(to the power of 5) cells of Fgf4-induced stem-cell-derived ES-like cells were injected subcutaneously into the dorsal flanks of 4-week-old NOD/SCID mice. Six weeks later, the implants were collected and histologically analysed. The implants were fixed with 10% formaldehyde, embedded in paraffin, and routinely processed into 4-μm-thick sections. Sections were stained with haematoxylin and eosin. So far, we have not investigated whether Fgf4-induced stem cells form tumours such as teratomas and yolk sac tumours in vivo.
体内分化実験
Fgf4誘導幹細胞由来ES様細胞の1×10の5乗個の細胞を4週齢NOD / SCIDマウスの背側腹部に皮下注射した。 6週間後インプラントを収集し、組織学的に分析した。 インプラントを10%ホルムアルデヒドで固定し、パラフィンに包埋し、普通のやり方で4μmの厚さに加工した。 切片をヘマトキシリンおよびエオシンで染色した。 これまでのところ、Fgf4誘導幹細胞が体内で奇形腫や卵黄嚢腫瘍などの腫瘍を形成するかどうかについては検討していない。
(英文)
Immunostaining
Cells were fixed with 4% PFA for 15 min and, after permeabilization, with 0.5% Triton X-100 and then incubated with primary antibodies: anti-H3K27me3 (Millipore; 1:300), anti-Oct3/4 (Santa Cruz Biotechnology; 1:300), anti-Nanog (eBioscience; 1:300), anti-KLF4 (R&D System; 1:300), anti-Esrrβ (R&D System; 1:300) and integrin α7 antibody (R&D system; 1:200). After overnight incubation, bound antibodies were visualized with a secondary antibody conjugated to Alexa546 (Molecular Probes). Nuclei were stained with DAPI (Molecular Probes).
免疫染色
細胞を4%PFAで15分間固定し、0.5%Triton X-100で透過処理後、以下の一時抗体で保温維持した:抗H3K27me3(Millipore; 1:300)、抗Oct3 / 4(Santa Cruz Biotechnology;1:300)、抗Nanog(eBioscience; 1:300)、抗KLF4(R&D System; 1:300)、抗Esrrβ(R&D System; 1:300)およびインテグリンα7抗体(R&D system; 1:200 )。 一晩保温維持した後、結合した抗体をAlexa546(Molecular Probes)を配合した二次抗体で視覚化した。 核をDAPI(Molecular Probes)で染色した。
(英文)
RNA preparation and RT–PCR analysis
RNA was isolated with the RNeasy Mini kit (Qiagen). Reverse transcription was performed with the SuperScript III First Strand Synthesis kit (Invitrogen). Power SYBR Green Mix (Roche Diagnostics) was used for PCR amplification, and samples were run on a Lightcycler-II Instrument (Roche Diagnostics). The primer sets for each gene are listed in Supplementary Table 1.
RNA調製およびRT-PCR分析
RNeasy Miniキット(Qiagen)を用いてRNAを単離した。 逆転写は、SuperScript IIIファーストストランド合成キット(Invitrogen)を用いて行った。 Power SYBR Green Mix(Roche Diagnostics)をPCR増幅に使用し、サンプルをLightcycler-II Instrument(Roche Diagnostics)で実行した。 各遺伝子のプライマーセットを補遺表1に示す。
(英文)
Inhibitor assay
For JAK inhibitor assay, Fgf4-induced stem cells were cultured without feeders for 48 h in trophoblast stem-cell culture medium supplemented with 0.6 μM JAK inhibitor (CalBiochem, 420097). As a control, ES cells were also cultured for 48 h in ES medium supplemented with 0.6 μM JAK inhibitor. After the JAK inhibitor treatment, cells were collected and their gene expression was analysed by RT–PCR. For MEK inhibitor assay, dissociated Fgf4-induced stem cells were plated in either LIF containing ES medium supplemented with 1 μM MEK inhibitor (PD025901) or FGF4 containing trophoblast stem cell medium supplemented with 1 μM MEK inhibitor for 48 h. As controls, dissociated Fgf4-induced stem cells were co-plated with 5% or 50% of ES cells into the same culture conditions. After the MEK inhibitor treatment, colonies that formed in each culture condition were counted.
阻害剤実験
JAK阻害剤実験のために、0.6μMのJAK阻害剤(CalBiochem、420097)を補充した栄養膜幹細胞培養培地中でFgf4誘導幹細胞をフィーダーなしで48時間培養した。 コントロールとして、ES細胞を0.6μMのJAK阻害剤を補充したES培地で48時間培養した。 JAK阻害剤処理の後、細胞を収集し、それらの遺伝子発現をRT-PCRによって分析した。 MEK阻害剤アッセイのために、解離したFgf4誘発幹細胞を1μMのMEK阻害剤(PD025901)を補充したLIF含有ES培地、または1μMのMEK阻害剤を補充した栄養膜幹細胞培地を含むFGF4培地に48時間播種した。コントロールとして、解離したFgf4誘導性幹細胞を、5%または50%のES細胞と共培養した。 MEK阻害剤処理後、各培養条件で形成されたコロニーを数えた。
(英文)
FACS sorting
Fgf4-induced stem cells were dissociated into single cells and were suspended in 0.5% BSA PBS. Suspended cells were Fc-blocked by treatment with 1 μg of mouse IgG per 10(to yhe power of 5) cells for 15 min at room temperature. PE-conjugated integrin α7 antibody (R&D system, FAB3518P, dilution at 1:10) was added into cell suspension, and cells were incubated for 30 min on ice. Finally, cells were rinsed with PBS three times and propidium iodide was added for dead cell elimination. As a control, Fgf4-induced stem cells in a separate tube were treated with PE-labelled rat IgG2B antibody. Integrin α7-positive and -dim cells were sorted by FACS aria II (BD).
FACSソーティング
Fgf4誘導幹細胞を単細胞に解離させ、0.5%BSA PBSに懸濁させた。 懸濁した細胞を、室温で15分間、10の5乗細胞あたり1μgのマウスIgGで処理することによってFc-遮断した。PE結合インテグリンα7抗体(R&Dシステム、FAB3518P、1:10希釈)を細胞懸濁液に加え、細胞を氷上で30分間インキュベートした。 最後に、細胞をPBSで3回すすぎ、死細胞除去のためにヨウ化プロピジウムを添加した。 コントロールとして、別のチューブ中のFgf4誘導幹細胞をPE標識ラットIgG2B抗体で処理した。 インテグリンα7陽性および 弱発現細胞をFACS aria II(BD)で選別した。
(英文)
RNA sequencing and ChIP sequencing analyses
RNA-sequencing of cell lines was performed with biological duplicate samples. Total RNA was extracted from T cells by the RNasy mini kit (Qiagen). RNA-seq libraries were prepared from 1 μg total RNAs following the protocol of the TruSeq RNA Sample Prep kit (Illumina) and subjected to the deep sequencing analysis with Illumina Hi-Seq1000. A cluster tree diagram of various cell types was obtained from hierarchical clustering of global expression profiles (log2 FPKM of all transcripts; FPKM, fragments per kilobase of transcript per million mapped reads). Complete linkage method applied to 1 - r (r = Pearson’s correlation between profiles) was used for generating the tree and 1,000 cycles of bootstrap resampling were carried out to obtain statistical confidence score in % units (also called AU P values). For the analysis that included morula and blastocyst embryos (only small amounts of RNA can be obtained from them), we used pre-amplification with the SMARTer Ultra Low RNA kit for Illumina Sequencing (Clontech Laboratories). Differentially expressed genes were identified by the DESeq package23.
RNAシークエンシングおよびChIPシークエンシング解析
生物学的二重試料を用いて細胞系のRNA配列決定を行った。全RNAをRNasyミニキット(Qiagen)によりT細胞から抽出した。 RNA-seqライブラリーは、TruSeq RNA Sample Prepキット(イルミナ)のプロトコールに従って1μgの全RNAから調製し、Illumina Hi-Seq1000で深い配列決定分析を行った。全発現プロファイルの(全転写物のlog2 FPKM; FPKMは、マップされた百万リードに対して、転写物のキロベースあたりの断片数を意味する)階層的クラスタリングから、様々な細胞型のクラスターツリー図を得た。ツリーを作成するために、1-r(r=プロファイル間のピアソン相関係数)に適用された完全リンケージ法を使用し、%単位(AU P値とも呼ばれる)で統計的信頼スコアを得るために1,000サイクルのブートストラップ再サンプリングを実施した。桑実胚および胚盤胞胚を含む分析(少量のRNAしか得られない)に関しては、Illumina Sequencing(Clontech Laboratories)用のSMARTer Ultra Low RNAキットで事前増幅を行った。異様発現遺伝子は、DESeqパッケージ23によって同定された。
(英文)
ChIP-seq libraries were prepared from 20 ng input DNAs, 1 ng H3K4me3 ChIP DNAs, or 5 ng H3K27me3 ChIP DNAs using the KAPA Library Preparation kit (KAPA Biosystems). TruSeq adaptors were prepared in-house by annealing a TruSeq universal oligonucleotide and each of index oligonucleotides (5′-AATGATACGGCGACCACCGAGATCTACACTCTTTCCCTACACGACGCTCTTCCGATCT-3′, and 5′-GATCGGAAGAGCACACGTCTGAACTCCAGTCACXXXXXXATCTCGTATGCCGTCTTCTGCTTG-3′; where X represents index sequences).
Chromatin immunoprecipitation was performed as follows. Cells were fixed in PBS(-) containing 1% formaldehyde for 10 min at room temperature. Glycine was added to a final concentration of 0.25 M to stop the fixation. After washing the cells twice in ice-cold PBS(-), cells were further washed in LB1 (50 mM HEPES-KOH pH 7.5, 140 mM NaCl, 1 mM EDTA, 10% glycerol, 0.5% NP-40, 0.25% Triton X-100) and LB2 (10 mM Tris-HCl pH 8.0, 200 mM NaCl, 1 mM EDTA, 0.5 mM EGTA). Cells were then re-suspended in lysis buffer (50 mM Tris-HCl pH 8.0, 10 mM EDTA, 1% SDS). Lysates were prepared by sonication using COVARIS S220 in a mini tube at duty cycle = 5%, PIP = 70, cycles per burst = 200, and the treatment time of 20 min. Lysates from 2 × 106 cells were diluted in ChIP dilution buffer (16.7 mM Tris-HCl pH 8.0, 167 mM NaCl, 1.2 mM EDTA, 1.1% Triton X-100, 0.01% SDS). ChIP was performed using sheep anti-mouse IgG beads (Invitrogen) or protein A beads (Invitrogen) coupled with anti-histone H3K4me3 antibody (Wako, catalogue no. 307-34813) or anti-histone H3K27me3 antibody (CST, catalogue no. 9733), respectively.
ChIP-seqライブラリーを、20ngの入力DNA、1ngのH3K4me3 ChIP DNA、または5ngのH3K27me3 ChIP DNAから、KAPAライブラリー調製キット(KAPA Biosystems)を用いて調製した。 TruSeqアダプターは、TruSeqユニバーサルオリゴヌクレオチドおよび各インデックスオリゴヌクレオチド(5'-AATGATACGGCGACCACCGAGATCTACACTCTTTCCCTACACGCGCTCTTCCGATCT-3 'および5'-GATCGGAAGAGCACACGTCTGAACTCCAGTCACXXXXXXATCTCGTATGCCGTCTTCTGCTTG-3';ここで、Xはインデックス配列を表す)のアニーリングによって社内で調製した。
クロマチン免疫沈降は以下のように行った。細胞を1%ホルムアルデヒドを含むPBS( - )中で室温で10分間固定した。グリシンを最終濃度0.25Mになるように加えて固定を停止させた。氷冷PBS( - )で細胞を2回洗浄した後、LB1(50mM HEPES-KOH pH7.5,140mM NaCl、1mM EDTA、10%グリセロール、0.5%NP-40,0.25%Triton X-100)およびLB2(10mMトリス-HCl pH8.0,200mM NaCl、1mM EDTA、0.5mM EGTA)で洗浄した。次いで、細胞を溶解緩衝液(50mMトリス-HCl pH8.0,10mM EDTA、1%SDS)に再懸濁した。溶解物は、デューティーサイクル= 5%、PIP = 70、バースト当たりのサイクル= 200、および20分の処理時間でミニチューブ中でCOVARIS S220を使用する超音波処理によって調製した。 2×10 の6乗細胞からの溶解物をChIP希釈緩衝液(16.7mMトリス-HCl pH8.0,167mM NaCl、1.2mM EDTA、1.1%Triton X-100,0.01%SDS)で希釈した。 ChIPは、抗ヒストンH3K4me3抗体(Wako、カタログ番号307-34813)または抗ヒストンH3K27me3抗体(CST、カタログ番号9733)と結合したヒツジ抗マウスIgGビーズ(Invitrogen)またはプロテインAビーズ(Invitrogen) )を使って実施された。
(英文)
After 4–6 h of incubation in a rotator at 4 °C, beads were washed five times in low-salt wash buffer (20 mM Tris HCl pH 8.0, 150 mM NaCl, 2 mM EDTA, 1% Triton X-100, 0.1% SDS), and three times in high-salt wash buffer (20 mM Tris-HCl pH 8.0, 500 mM NaCl, 2 mM EDTA, 1% Triton X-100, 0.1% SDS). Target chromatin was eluted off the beads in elution buffer (10 mM Tris-HCl pH 8.0, 300 mM NaCl, 5 mM EDTA, 1% SDS) at room temperature for 20 min. Crosslink was reversed at 65 °C, and then samples were treated with RNaseA and proteinase K. The prepared DNA samples were purified by phenol-chloroform extraction followed by ethanol precipitation and dissolved in TE buffer.
4℃で回転子中で4~6時間保温した後、ビーズを低塩洗浄緩衝液(20mM Tris HCl pH8.0,150mM NaCl、2mM EDTA、1%Triton X-100,0.1 %SDS)で5度洗浄し、高塩洗浄緩衝液(20mM Tris-HCl pH8.0,500mM NaCl、2mM EDTA、1%Triton X-100,0.1%SDS)中で3度洗浄した。 溶出緩衝液(10mMトリス-HCl pH8.0,300mM NaCl、5mM EDTA、1%SDS)中、室温で20分間、標的クロマチンをビーズから溶出させた。 65℃で架橋を逆転させた後、サンプルをRNaseAおよびプロテイナーゼKで処理した。調製したDNAサンプルをフェノール - クロロホルム抽出および続いてエタノール沈殿により精製し、TE緩衝液に溶解した。
- 2019/05/14(火) 09:13:57|
- レター論文
-
-
| コメント:0
(英文)
References
1. Obokata, H. et al. Stimulus-triggered fate conversion of somatic cells into pluripotency. Nature 505, 641–647 (2014)
2. Gurdon, J. B. The developmental capacity of nuclei taken from intestinal epithelium cells of feeding tadpoles. J. Embryol. Exp. Morphol. 10, 622–640 (1962)
3. Wakayama, T., Perry, A. C., Zuccotti, M., Johnson, K. R. & Yanagimachi, R. Full-term development of mice from enucleated oocytes injected with cumulus cell nuclei. Nature 394, 369–374 (1998)
4. Takahashi, K. & Yamanaka, S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell 126, 663–676 (2006)
5. Nagy, A., Rossant, J., Nagy, R., Abramow-Newerly, W. & Roder, J. C. Derivation of completely cell culture-derived mice from early-passage embryonic stem cells. Proc. Natl Acad. Sci. USA 90, 8424–8428 (1993)
参考文献
1. Obokata, H. et al. 体細胞の多能性への刺激誘発性運命変換。 Nature 505, 641–647 (2014)
2. Gurdon, J. B. オタマジャクシの腸上皮細胞から採取した核の発生能。 J. Embryol. Exp. Morphol. 10, 622–640 (1962)
3. Wakayama, T., Perry, A. C., Zuccotti, M., Johnson, K. R. & Yanagimachi, R. 卵丘細胞核を注入した除核卵母細胞からのマウスの全期間発生。 Nature 394, 369–374 (1998)
4. Takahashi, K. & Yamanaka, S. 定義された因子によるマウス胚性および成人線維芽細胞培養からの多能性幹細胞の誘導。 Cell 126, 663–676 (2006)
5. Nagy, A., Rossant, J., Nagy, R., Abramow-Newerly, W. & Roder, J. C. 早期継代胚性幹細胞からの完全に細胞培養由来のマウス誘導。 Proc. Natl Acad. Sci. USA 90, 8424–8428 (1993)
(英文)
6. Niwa, H. How is pluripotency determined and maintained? Development 134, 635–646 (2007)
7. Beddington, R. S. & Robertson, E. J. An assessment of the developmental potential of embryonic stem cells in the midgestation mouse embryo. Development 105, 733–737 (1989)
8. Quinn, J., Kunath, T. & Rossant, J. Mouse trophoblast stem cells. Methods Mol. Med. 121, 125–148 (2006)
9. Tanaka, S., Kunath, T., Hadjantonakis, A. K., Nagy, A. & Rossant, J. Promotion of trophoblast stem cell proliferation by FGF4. Science 282, 2072–2075 (1998)
10. Tanaka, T. S. et al. Gene expression profiling of embryo-derived stem cells reveals candidate genes associated with pluripotency and lineage specificity. Genome Res. 12, 1921–1928 (2002)
6. Niwa, H. 多能性は如何に決定され、維持されるか? Development 134, 635–646 (2007)
7. Beddington, R. S. & Robertson, E. J.妊娠中期マウス胚における胚性幹細胞の発生能の評価。 Development 105, 733–737 (1989)
8. Quinn, J., Kunath, T. & Rossant, J. マウス栄養膜幹細胞。 Methods Mol. Med. 121, 125–148 (2006)
9. Tanaka, S., Kunath, T., Hadjantonakis, A. K., Nagy, A. & Rossant, J. FGF4による栄養膜幹細胞増殖の促進。 Science 282, 2072–2075 (1998)
10. Tanaka, T. S. et al. 胚由来幹細胞の遺伝子発現プロファイリングは、多分化能および系統特異性に関連する候補遺伝子を明らかにする。Genome Res. 12, 1921–1928 (2002)
(英文)
11. Klaffky, E. et al. Trophoblast-specific expression and function of the integrin alpha 7 subunit in the peri-implantation mouse embryo. Dev. Biol. 239, 161–175 (2001)
12. Russ, A. P. et al. Eomesodermin is required for mouse trophoblast development and mesoderm formation. Nature 404, 95–99 (2000)
13. Niwa, H. et al. Interaction between Oct3/4 and Cdx2 determines trophectoderm differentiation. Cell 123, 917–929 (2005)
14. Mikkelsen, T. S. et al. Dissecting direct reprogramming through integrative genomic analysis. Nature 454, 49–55 (2008)
15. van Oosten, A. L., Costa, Y., Smith, A. & Silva, J. C. JAK/STAT3 signalling is sufficient and dominant over antagonistic cues for the establishment of naive pluripotency. Nature Commun. 3, 817 (2012)
16. Yang, J. et al. Stat3 activation is limiting for reprogramming to ground state pluripotency. Cell Stem Cell 7, 319–328 (2010)
17. Ying, Q. L. et al. The ground state of embryonic stem cell self-renewal. Nature 453, 519–523 (2008)
11. Klaffky, E. et al. 移植前後のマウス胚におけるインテグリンα7サブユニットの栄養膜特異的発現および機能。 Dev. Biol. 239, 161–175 (2001)
12. Russ, A. P. et al. マウス栄養膜の発達および中胚葉形成にEomesoderminが必要。 Nature 404, 95–99 (2000)
13. Niwa, H. et al. Oct3 / 4とCdx2との間の相互作用が栄養外胚葉の分化を決定する。 Cell 123, 917–929 (2005)
14. Mikkelsen, T. S. et al.統合的ゲノム分析による直接再プログラミングの解明。 Nature 454, 49–55 (2008)
15. van Oosten, A. L., Costa, Y., Smith, A. & Silva, J. C.JAK / STAT3シグナル伝達は、原初多能性の確立に関する対立的開始合図を凌いで、十分であり、かつ圧倒的である。 Nature Commun. 3, 817 (2012)
16. Yang, J. et al. Stat3活性化は、基底多能性への再プログラミングを制限している。 Cell Stem Cell 7, 319–328 (2010)
17. Ying, Q. L. et al.胚性幹細胞の基底状態は自己再生する。 Nature 453, 519–523 (2008)
(英文)
18. Bernstein, B. E. et al. A bivalent chromatin structure marks key developmental genes in embryonic stem cells. Cell 125, 315–326 (2006)
19. Meek, S. et al. Tuning of β-catenin activity is required to stabilize self-renewal of rat embryonic stem cells. Stem Cells 31, 2104–2115 (2013)
20. Chen, Y., Blair, K. & Smith, A. Robust self-renewal of rat embryonic stem cells requires fine-tuning of glycogen synthase kinase-3 inhibition. Stem Cell Rep. 1, 209–217 (2013)
21. Debeb, B. G. et al. Isolation of Oct4-expressing extraembryonic endoderm precursor cell lines. PLoS ONE 4, e7216 (2009)
22. Macfarlan, T. S. et al. Embryonic stem cell potency fluctuates with endogenous retrovirus activity. Nature 487, 57–63 (2012)
23. Anders, S. & Huber, W. Differential expression analysis for sequence count data. Genome Biol. 11, R106 (2010)
18. Bernstein, B. E. et al. 二価クロマチン構造は、胚性幹細胞における重要な発生遺伝子をマークする。 Cell 125, 315–326 (2006)
19. Meek, S. et al. ラット胚性幹細胞の自己再生を安定化させるためにβ-カテニン活性の調整が必要である。 Stem Cells 31, 2104–2115 (2013)
20. Chen, Y., Blair, K. & Smith, A. ラット胚性幹細胞の強力な自己再生には、グリコーゲンシンターゼキナーゼ-3阻害の微調整が必要である。 Stem Cell Rep. 1, 209–217 (2013)
21. Debeb, B. G. et al. Oct4発現胚体外胚葉前駆細胞株の単離。 PLoS ONE 4, e7216 (2009)
22. Macfarlan, T. S. et al. 胚性幹細胞の効力は、内因性レトロウイルス活性と共に変動する。 Nature 487, 57–63 (2012)
23. Anders, S. & Huber, W. 配列カウントデータのための特異的発現分析。 Genome Biol. 11, R106 (2010)
(英文)
Acknowledgements
We thank S. Nishikawa and N. Love for discussion and M. Ohgushi, S. Kuraku, M. Eiraku, S. Ohtsuka and K. Kakiguchi for help with experimental planning, material preparation and analyses. Financial support for this research was provided by Intramural RIKEN Research Budget (H.O., T.W. and Y.S.), a Scientific Research in Priority Areas (20062015) to T.W., the Network Project for Realization of Regenerative Medicine to Y.S., and Department of Anesthesiology, Perioperative and Pain Medicine at Brigham and Women’s Hospital to C.A.V.
謝辞
私たちは、討論に関してS. Nishikawa と N. Loveに、実験計画、材料の準備と分析の援助に関して、M. Ohgushi、S. Kuraku、M. Eiraku、S. Ohtsuka 及び K. Kakiguchiに謝意を表する。本研究の資金援助は、理研内の理研研究予算(小保方晴子、若山照彦、笹井芳樹)、若山輝彦への優先分野の科学研究(20062015)、笹井芳樹への再生医療の実現のためのネットワークプロジェクト、及びチャールズ・A・ヴァカンティへのブリガム・ウィミンズ病院麻酔部門術後処置と痛み治療科によって提供された。
(英文)
Author information
Affiliations
1. Laboratory for Cellular Reprogramming, RIKEN Center for Developmental Biology, Kobe 650-0047, Japan
Haruko Obokata &
Yukari Terashita
2. Laboratory for Genomic Reprogramming, RIKEN Center for Developmental Biology, Kobe 650-0047, Japan
Haruko Obokata,
Mikiko Tokoro,
Yukari Terashita &
Teruhiko Wakayama
著者情報
所属
1.細胞リプログラミングのための研究室、理化学研究所発生生物学センター、神戸650-0047、日本
Haruko Obokata &
Yukari Terashita
2.ゲノムリプログラミングのための研究室、理化学研究所発生生物学センター、神戸650-0047、日本
Haruko Obokata,
Mikiko Tokoro,
Yukari Terashita &
Teruhiko Wakayama
(英文)
3. Laboratory for Tissue Engineering and Regenerative Medicine, Brigham and Women’s Hospital, Harvard Medical School, Boston, Massachusetts 02115, USA
Haruko Obokata &
Charles A. Vacanti
4. Laboratory for Organogenesis and Neurogenesis, RIKEN Center for Developmental Biology, Kobe 650-0047, Japan
Yoshiki Sasai &
Nozomu Takata
5. Laboratory for Pluripotent Stem Cell Studies, RIKEN Center for Developmental Biology, Kobe 650-0047, Japan
Hitoshi Niwa
3.組織工学および再生医療のための研究室、ブリガム・ウィミンズ病院、ハーバード大学医学部、ボストン、マサチューセッツ州02115、米国
Haruko Obokata &
Charles A. Vacanti
4.器官形成および神経発生のための研究室、理化学研究所発生生物学センター、神戸650-0047、日本
Yoshiki Sasai &
Nozomu Takata
5.多能性幹細胞学のための研究室、理化学研究所発生生物学センター、神戸650-0047、日本
Hitoshi Niwa
(英文)
6. Genome Resource and アnalysis Unit, RIKEN Center for Developmental Biology, Kobe 650-0047, Japan
Mitsutaka Kadota &
Munazah Andrabi
7. Electron Microscopy Laboratory, RIKEN Center for Developmental Biology, Kobe 650-0047, Japan
Shigenobu Yonemura
8. Faculty of Life and Environmental Sciences, University of Yamanashi, Yamanashi 400-8510, Japan
Teruhiko Wakayama
6.ゲノムリソース解析ユニット、理化学研究所発生生物学センター、神戸650-0047、日本
Mitsutaka Kadota &
Munazah Andrabi
7.電子顕微鏡検査室、理化学研究所発生生物学センター、神戸650-0047、日本
Shigenobu Yonemura
8.生命環境科学学部、山梨大学、山梨400-8510、日本
Teruhiko Wakayama
(英文)
Contributions
H.O. and Y.S. wrote the manuscript. H.O., Y.S., M.K., M.A., N.T., S.Y. and T.W. performed experiments, and M.T. and Y.T. assisted with H.O.’s experiments. H.O., Y.S., H.N., C.A.V. and T.W. designed the project.
Competing financial interests
The authors declare no competing financial interests.
Corresponding authors
Correspondence to:
Haruko Obokata or
Teruhiko Wakayama or
Yoshiki Sasai
貢献
H.O. 、Y.S. が原稿執筆し、 H.O.、Y.S.、M.K.、M.A.、N.T.、S.Y. 、T.W. が実験実施し、M.T. 、Y.T. がH.O.の実験補助し、 H.O.、Y.S.、H.N.、C.A.V. T.W. がプロジェクトを設計した。
利益相反
著者らは、利益相反の無いことを宣言する。
責任著者
下記へ連絡
Haruko Obokata or
Teruhiko Wakayama or
Yoshiki Sasai
(英文)
RNA-seq and ChIP-seq files have been submitted to the NCBI BioSample databases under accessions SAMN02393426, SAMN02393427, SAMN02393428, SAMN02393429, SAMN02393430, SAMN02393431, SAMN02393432, SAMN02393433, SAMN02393434 and SAMN02393435.
RNA-seqおよびChIP-seqファイルは、SAMBI02393426、SAMN02393427、SAMN02393428、SAMN02393429、SAMN02393430、SAMN02393431、SAMN02393431、SAMN02393432、SAMN02393433、SAMN02393434およびSAMN02393435としてNCBI BioSampleデータベースに提出されている。
- 2019/05/14(火) 09:22:27|
- レター論文
-
-
| コメント:0
(英文)
Extended Data Figures
1. Extended Data Figure 1: Placental contribution of STAP cells. (295 KB)
a, Chimaeric mouse with STAP cells derived from CD45+ cells of B6GFP × 129/Sv mice (B6GFP, C57BL/6 line with cag-gfp transgene). Arrows indicate a placenta and a yolk sac. b, Cross-sections of yolk sac (top) and placenta (bottom). GFP-positive cells (arrows) were seen only in yolk sac and placenta of the STAP cell chimaera. Scale bars, 50 μm. c, Co-immunostaining showed that these GFP-positive cells (right) were found in the extra-embryonic endoderm-derived epithelial cells (pan-cytokeratin+ and overlying laminin+ basement membrane; left) of the yolk sac. Scale bar, 10 μm.
拡張データ図
1.拡張データ図1:STAP細胞の胎盤寄与。 (295 KB)
a、B6GFP×129 / Svマウス(B6GFP、cag-gfp導入遺伝子を有するC57BL / 6系統)のCD45 陽性細胞に由来するSTAP細胞のキメラマウス。 矢印は、胎盤および卵黄嚢を示す。 b、卵黄嚢(上)および胎盤(下)の断面。 GFP陽性細胞(矢印)は、STAP細胞キメラの卵黄嚢および胎盤においてのみ見られた。 スケールバー、50μm。 c、共染色結果は、これらのGFP陽性細胞(右)が卵黄嚢の胚外内胚葉由来上皮細胞(汎サイトケラチン陽性かつ重層ラミニン陽性の基底膜;左側)に見出されたことを示した。 スケールバー、10μm。
(英文)
2. Extended Data Figure 2: Trophoblast differentiation potential of Fgf4-induced stem cells. (749 KB)
a, b, Immunostaining (cross-section) of placentae obtained in the blastocyst injection assay with GFP (constitutive)-labelled ES cells (upper) or Fgf4-induced stem cells (bottom). Brown shows pan-cytokeratin and red shows GFP (ES cell or Fgf4-induced stem cell contribution). Regions indicated in a are shown in b. Fgf4-induced stem cells contributed to all layers of placentae, whereas no contribution was observed with ES cells. a, Scale bars, 5 mm. b, Scale bars, 50 μm. c, Pluripotent marker expression of Fgf4-induced stem cells. Scale bars, 50 μm.
d, e, Effects of Fgf4 withdrawal from Fgf4-induced stem cell culture. Unlike trophoblast stem cells (d, left), which generated multi-nucleated large cells (arrow) in the absence of Fgf4, Fgf4-induced stem cells (d, right) simply stopped proliferation and gradually died on Fgf4 withdrawal. Scale bars, 50 μm. This finding suggests that placental differentiation of Fgf4-induced stem cells in vivo may involve more than just Fgf4 signal suppression. e, The number of 4N and 8N cells increased within 6 days of Fgf4 withdrawal in trophoblast stem cells but not in Fgf4-induced stem cells.
2.拡張データ図2:Fgf4誘導幹細胞の栄養膜分化能。 (749 KB)
a,b,GFP(恒常性)標識ES細胞(上)またはFgf4誘導幹細胞(下)を用いた胚盤胞注入実験で得られた胎盤の免疫染色(断面)。 ブラウンは汎サイトケラチンを示し、赤はGFP(ES細胞またはFGF4誘導性幹細胞寄与)を示す。 aに示される領域は、bに示されている。 Fgf4誘導性幹細胞は胎盤のすべての層に寄与したが、ES細胞は寄与しなかった。 a、スケールバー、5mm。 b、スケールバー、50μm。 c,Fgf4誘導幹細胞の多能性マーカー発現。 スケールバー、50μm。
d,e,Fgf4誘導幹細胞培養からFgf4を除去した効果。 Fgf4の非存在下で大きな多能有核細胞(矢印)を形成する栄養膜幹細胞(d、左)とは異なり、Fgf4誘導性幹細胞(d、右)はFgf4を除去すると、単に増殖を停止し、徐々に死亡した。 スケールバー、50μm。 この知見は、インビボでのFgf4誘導幹細胞の胎盤分化は、単にFgf4シグナルの抑制以上のものを含む可能性があることを示唆している。 e、4Nおよび8N細胞の数は、栄養膜幹細胞においてFgf4の除去から6日間まで増加したが、Fgf4誘導性幹細胞では増加しなかった。
(英文)
3. Extended Data Figure 3: Transcriptome analyses of STAP cells shown by heat maps. (494 KB)
a, Heat maps of expression profiles of top-ranked up- and downregulated genes in STAP cells (Oct4-GFP+ clusters converted from CD45+ cells) compared to ES cells. Their respective expression levels in STAP stem cells, trophoblast stem cells and Fgf4-induced stem cells are shown. Absolute expression values are scaled by log2. The genes expressed differentially between ES cells and STAP cells tended to show more similar expression profiles to ES cells in STAP stem cells and Fgf4-induced stem cells than in trophoblast stem cells. Expression of some early endodermal lineage genes such as Gata4 and Sox17 was moderately elevated in STAP cells as compared to ES cells, whereas its biological significance remains elusive (these genes are shown to be strongly expressed in Oct4-GFP-dim cells1). b, Heat maps of expression profiles of top-ranked up- and downregulated genes in ES cells compared to CD45+ cells and their respective expression levels in STAP cells.
The genes expressed differentially between CD45+ and ES cells tended to show similar expression profiles in ES cells and STAP cells. c, Heat maps of expression profiles of representative genes implicated in haematopoietic lineage development in CD45+, ES and STAP cells. No strong correlation was seen between CD45+ cells and STAP cells in their expression profiles (a similar tendency of no correlation was seen for the data in b).
拡張データ図3:ヒートマップ<翻訳機訳注:個々の値のデータ行列を色として表現した可視化グラフ>によって示されるSTAP細胞のトランスクリプトーム<翻訳機訳注:特定の状況下において細胞中に存在する全てのmRNA(ないしは一次転写産物、 transcripts)の総体を指す呼称>解析。 (494 KB)
a,ES細胞と比較した、STAP細胞(CD45陽性細胞から変換されたOct4-GFP陽性クラスター)における上位ランクのアップ或いはダウンレギュレート<翻訳機訳注:転写物の増減により製造蛋白質の量が増減する>された遺伝子の発現プロファイルのヒートマップ。 STAP幹細胞、栄養膜幹細胞およびFgf4誘導幹細胞のそれぞれの発現レベルが示されている。 発現の絶対値はlog2(翻訳機訳注:Excel関数用語で2を底とする対数の意、数学定義の常用対数、自然対数のLog2ではない。)でスケールされている(翻訳機訳注:横の色分けバー)。ES細胞とSTAP細胞との間の遺伝子発現の違いは、STAP幹細胞と栄養膜幹細胞よりも、STAP幹細胞とFgf4誘導幹細胞に、より類似した発現プロファイルを示す傾向があった。 Gata4およびSox17のようないくつかの初期内胚葉系遺伝子の発現は、ES細胞と比較してSTAP細胞では適度に上昇したが、その生物学的意義は依然として分かっていない(これらの遺伝子はOct4-GFP弱発現細胞で強く発現することが示されている)。 b,CD45 陽性細胞と比較した、ES細胞におけるトップランクのアップ或いはダウンレギュレートされた遺伝子の発現プロファイルのヒートマップおよびSTAP細胞のそれらに対応する発現レベル。
CD45 陽性細胞とES細胞との間の発現遺伝子の違いはSTAP細胞においても同様の傾向があった。 c,CD45陽性、ES細胞およびSTAP細胞における造血系統発生に関与する代表的遺伝子の発現プロファイルのヒートマップ。 CD45陽性細胞とSTAP細胞との間には、その発現プロファイルにおいて強い相関は見られなかった(bのデータについても同様の傾向は見られなかった)。
(英文)
4. Extended Data Figure 4: Transcriptome analyses for genes implicated in cell-cycle control and induced pluripotent stem-cell conversion. (452 KB)
a, Comparison of expression values of genes involved in cell-cycle control in ES and STAP cells; the G to M cell cycle phases (upper), the cell cycle checkpoint and cell cycle arrest (middle), and the cell cycle regulation (bottom) are shown. Expression level was measured by log2 of mean normalized counts. b, Heat map for upregulated genes in cells undergoing reprogramming by ‘Yamanaka factors’[14]. c, Heat maps for upregulated genes in pre-iPS cells[15] (top) and in partially reprogrammed cells by Yamanaka factors (bottom)[14]. Expression level was measured by log2 of mean normalized counts. Differentially expressed genes were identified by the DESeq package[21] and only genes with a false discovery rate of 1% were selected for comparison, unless mentioned otherwise.
拡張データ図4:細胞周期制御および誘導された多能性幹細胞変換に関与する遺伝子のトランスクリプトーム解析。 (452 KB)
a,ES及びSTAP細胞における細胞周期制御に関与する遺伝子の発現値の比較; GからM細胞周期相(翻訳機訳注:細胞分裂のG0,G1,S,G2,Mの各段階)(上)、細胞周期チェックポイントおよび細胞周期停止段階(中)および細胞周期調節段階(下)が示されている。 発現レベルは平均正規化カウントのlog2によって測定されている。 b,「Yamanaka因子」[14]によって再プログラミングされている細胞におけるアップレギュレートされた遺伝子のヒートマップ。 c,pre-iPS細胞[15](上)およびYamanaka因子[14](下)による部分的に再プログラムされた細胞におけるアップレギュレートされた遺伝子のヒートマップ。 発現レベルは平均正規化カウントのlog2によって測定されている。。 示差的に発現された遺伝子は、DESeqパッケージ[21]によって同定され、他に言及されない限り、誤発見率1%の遺伝子のみが比較のために選択された。
(英文)
5. Extended Data Figure 5: Responses of Fgf4-induced stem cells to signal modifications. (333 KB)
a–f, JAK inhibitor treatment assay for Fgf4-induced stem cells. Fgf4-induced stem cells were cultured under feeder-free conditions and treated with 0.6 μM JAK inhibitor for 48 h. JAK inhibitor treatment assay eliminated ES cells (Oct4-GFP+) from the culture (a, b). The level of Oct4-GFP expression in Fgf4-induced stem cells, which was moderate, was maintained even after JAK inhibitor treatment (c, d; three independent experiments). Scale bar, 100 μm. e, f, For an additional control, Fgf4-induced stem cells were plated in trophoblast stem-cell medium containing Fgf4 together with Oct4-GFP ES cells that constitutively expressed BFP (the number of plated cells was one-tenth of that of plated Fgf4-induced stem cells). Whereas BFP-expressing colonies (ES-cell-derived) still expressed Oct4-GFP in trophoblast stem-cell culture medium after 2 days (e), no Oct4-GFP+ colonies from BFP-expressing ES cells were observed in the JAK-inhibitor-treated culture (f).
g, FACS analysis of integrin α7 expression in Fgf4-induced stem cells. Over 40% of Fgf4-induced stem cells strongly expressed both the pluripotency marker Oct4-GFP and the trophoblast marker integrin α7. The bottom panel shows an isotype control for integrin α7 antibody. In ES cells, integrin-α7-expressing cells were less than 0.1% (data not shown; three independent ES cell lines were examined).
拡張データ図5:Fgf4誘導幹細胞のシグナル修飾に対する反応。 (333 KB)
a-f,Fgf4誘導幹細胞に関するJAK阻害剤処理実験。 Fgf4誘導幹細胞をフィーダー細胞無しで培養し、0.6μMのJAK阻害剤で48時間処理した。 JAK阻害剤処理実験は、ES細胞(Oct4-GFP 陽性)を培養物(a、b)から除去した。 Fgf4誘導幹細胞におけるOct4-GFP発現のレベルは、中等度ではあるが、JAK阻害剤処理後でも(c、d; 3回の独立した実験)維持された。 スケールバー、100μm。 e,f, 加えて別のコントロール実験として、Fgf4誘導性幹細胞を、Oct4-GFPとともにBFPを恒常的に発現する ES細胞(播種細胞数はFgf4誘導幹細胞数の数の1/10)と共にFgf4を含有する栄養膜幹細胞培地に播種した。 BFPを発現するコロニー(ES細胞由来)が2日後に栄養膜幹細胞培養培地中でOct4-GFPを依然として発現した(e)のに対して、BFP発現ES細胞由来のOct4-GFP 陽性コロニーはJAK阻害剤添加培地では観察されなかった(f)。
g,Fgf4誘導幹細胞のインテグリンα7発現のFACS解析。 Fgf4誘導幹細胞の40%以上が多能性マーカーであるOct4-GFPおよび栄養膜マーカーであるインテグリンα7の両方を強力に発現した。 下のパネルは、インテグリンα7抗体のアイソタイプコントロールを示す。 ES細胞では、インテグリンα7発現細胞は0.1%未満であった(データは示していない; 3つの独立したES細胞株を調べた)。
(英文)
6. Extended Data Figure 6: Characterization of ES-like cells converted from Fgf4-induced stem cells and comparison of STAP cells with early embryos. (316 KB)
a, Immunohistochemistry of ES-like cells for trophoblast and pluripotency markers. ES-like cells converted from Fgf4-induced stem cells no longer expressed the trophoblast marker (integrin alpha 7), but they did express the pluripotency markers (Oct4, Nanog and SSEA-1). Scale bar, 100 μm. b, Pluripotency of ES-like cells converted from Fgf4-induced stem cells as shown by teratoma formation. Those cells successfully formed teratomas containing tissues from all three germ layers: neuroepithelium (left, arrow indicates), muscle tissue (middle, arrow indicates) and bronchial-like epithelium (right). Scale bar, 100 μm. c, MEK inhibitor treatment assay for Oct4-gfp Fgf4-induced stem cells in trophoblast stem-cell medium containing Fgf4. No substantial formation of Oct4-GFP+ colonies was observed from dissociated Fgf4-induced stem cells in MEK-inhibitor-containing medium. Scale bar, 100 μm.
d, Cluster tree diagram from hierarchical clustering of global expression profiles. Red, AU P values. As this analysis included morula and blastocyst embryos from which only small amounts of RNA could be obtained, we used pre-amplification with the SMARTer Ultra Low RNA kit for Illumina Sequencing (Clontech Laboratories). e, f, Volcano plot of the expression profile of STAP cells compared to the morula (e) and blastocyst (f). Genes showing greater than 10-fold change and P value 1.0 × 10(to the power of-6 )are highlighted in red and are considered up- (or down-) regulated in the STAP cells.
拡張データ図6:Fgf4誘導幹細胞から変換されたES様細胞の特徴付けおよびSTAP細胞と初期胚との比較。 (316 KB)
a,栄養膜マーカーおよび多能性マーカーに関するES様細胞の免疫組織化学。Fgf4誘導幹細胞から変換されたES様細胞は、栄養膜マーカー (integrin alpha 7)をもはや発現しなかったが、それらは多能性マーカー(Oct4、NanogおよびSSEA-1)を発現した。スケールバー、100μm。 b,テラトーマ形成によって示されたFgf4誘導幹細胞から変換されたES様細胞の多能性。これらの細胞は三胚葉すべてからの組織を含むテラトーマをきれいに形成した:神経上皮(左、矢印が示す)、筋肉組織(中、矢印が示す)および気管支様上皮(右)。 スケールバー、100μm。 c,Fgf4を含有する栄養膜幹細胞培地中のOct4-gfp陽性Fgf4誘導幹細胞に対するMEK阻害剤処理実験。 MEK阻害剤含有培地中の解離したFgf4誘導細胞から、Oct4-GFP陽性コロニーの実質的な形成は観察されなかった。 スケールバー、100μm。
d、グローバルな発現プロファイルの階層的クラスタリングによるクラスタツリー図。 赤、AU P値。 この分析には、少量のRNAしか得られない桑実胚および胚盤胞胚が含まれていたため、Illumina Sequencing(Clontech Laboratories)用のSMARTer Ultra Low RNAキットでプレ増幅を行った。 e,f,桑実胚(e)および胚盤胞(f)と比較したSTAP細胞の発現プロフィールの火山プロット。 10倍を超える変化およびP値1.0×10マイナス6乗を示す遺伝子は赤色で強調表示され、STAP細胞において上方(または下方)に調節されると考えられる。
<サプリテーブルは省略 >
- 2019/05/14(火) 09:33:49|
- レター論文
-
-
| コメント:0



